Детские болезни : учебник / Геппе Н. А. - Москва : ГЭОТАР-Медиа, 2018. - 760 с. - ISBN 978-5-9704-4470-2 |
7.5. Болезни печени
Заболевания печени — группа разнородных наследственных и приобретенных заболеваний с разнообразной клинической картиной.
Наиболее частые симптомы поражения печени — желтуха и/или гепатомегалия (Болезни печени — классификация, см. ![]() ).
).
Выделяют биохимические синдромы, позволяющие провести дифференциальный диагноз патологии печени у детей (табл. 7.10).
| Синдром | Лабораторные проявления |
|---|---|
Цитолитический синдром (поражение гепатоцита) |
↑АСТ, АЛТ, лактатдегидрогеназы, глютаматдегидрогеназы |
Мезенхимально-воспалительный синдром (повышенная активность мезенхимальностромальных элементов печени) |
↑СОЭ, СРБ, Ig, γ-глобулинов |
Холестатический синдром (нарушение образования и выделения желчи) |
↑прямого билирубина, щелочной фосфатазы, ГГТ |
Синдром печеночной недостаточности |
↓общего белка, альбумина, протромбинового индекса, фибриногена, проконвертина |
Синдром портальной гипертензии |
↑аммиака |
Синдром регенерации и опухолевого роста |
↑α-фетопротеина |
Патогенез поражения печени (рис. 7.4). В результате воздействия этиологического фактора на гепатоцит возникает некроз или апоптоз гепатоцита с замещением его соединительной тканью — фиброз печени, когда архитектоника и кровоток в печени сохранены. Формирование фиброза печени происходит вследствие нарушения баланса между процессами распада и синтеза компонентов экстрацеллюлярного матрикса. Звездчатые клетки печени активируются различными повреждающими факторами (вирусы, алкоголь, аутоантитела, холестаз, метаболические расстройства). На поверхности звездчатых клеток печени увеличивается количество рецепторов к различным цитокинам, стимулирующим пролиферацию и фиброгенез (активные формы кислорода, инсулиноподобный фактор роста-1, фактор роста фибробластов, трансформирующий фактора роста-β1, ФНОα, ИЛ-1, эндотелин-1, интерферон γ, оксид азота). Активированные звездчатые клетки печени продуцируют внеклеточные матричные компоненты — коллагены I, III и IV типов, фибронектин и ламинин. При прогрессировании патологического процесса в пространстве Диссе образуется патологический коллагеновый матрикс (феномен «капилляризации синусоидов»), препятствующий нормальному обмену веществ между кровью синусоидов и гепатоцитами, что ведет к прогрессированию фиброза вплоть до развития ЦП (цирроза печени).
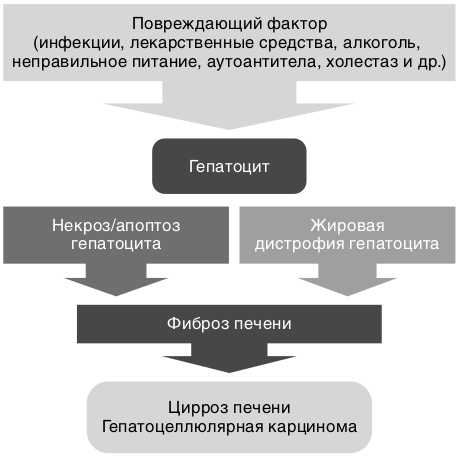
В условиях высокого уровня регенерации и пролиферации гепатоцитов значительно возрастает вероятность развития гепатоцеллюлярной карциномы. Более чем в 80% случаев злокачественную трансформацию наблюдают в цирротически измененной печени.
Рассмотрим наиболее часто встречающиеся заболевания печени у детей.
7.5.1. Хронические гепатиты
Хронический гепатит, согласно определению ВОЗ, — полиэтиологический пролонгированный (более 6 мес) диффузный воспалительный процесс в печени. Морфологически рецидивирующее воспаление представлено персистенцией некрозов, фиброза при сохранной архитектонике печени.
В настоящее время на земном шаре насчитывают около 300 млн человек, страдающих хроническими гепатитами.
В основу современной классификации хронических гепатитов положен этиологический принцип (табл. 7.11).
| Этиология | Активность заболевания | Стадия заболевания |
|---|---|---|
Хронический вирусный гепатит (В, С, D, G, F, TTV и др.). |
Минимальная. |
Без фиброза. |
При вирусных гепатитах необходимо установить фазу вирусной инфекции:
Клинические симптомы течения хронических гепатитов неспецифичны, но наиболее частые из них перечислены в рамке.
Клинические синдромы течения хронических гепатитов:
Среди вирусных гепатитов на долю ВГВ выпадает 40% случаев, ВГВ + гепатит D — 5%, гепатита С — 33%, G — 6%.
Хронические вирусные гепатиты
Хронический гепатит B (ХГВ)
Хронический ГВ (МКБ-10: В18.1) — инфекционное заболевание печени, обусловленное персистенцией ДНК-содержащего вируса семейства Hepadnaviridae. Выделяют 10 генотипов и большое число субгенотипов вируса гепатита В (ВГВ).
Приблизительно у 1/3 населения Земли выявляют маркеры перенесенного инфицирования вирусом гепатита В и у 350 млн человек — маркеры текущей хронической инфекции, характерной широким спектром клинических вариантов и исходов заболевания — от неактивного носительства вируса с низким уровнем виремии до хронического гепатита В с выраженной активностью и возможностью формирования неблагоприятных исходов — циррозом печени (ЦП) и гепатоцеллюлярной карциномы.
Основной путь передачи вируса — парентеральный. Более чем у половины больных детей с ХГВ формируется в раннем возрасте, причем ВГВ может передаваться плоду или новорожденному от HBSAg-позитивной и позитивной по Аg вируса гепатита В, не входящему в состав частиц Дейна (HBEAg), матери — вертикальный путь. Для вертикального пути передачи характерен наибольший процент хронизации инфекции (до 95%). ХГВ мальчики болеют чаще девочек, в соотношении 3:1. ХГВ может формироваться вследствие пролонгированного течения острого ВГВ, особенно у детей с генетически детерминированным дефицитом клеточного и макрофагального иммунитета, а также после атипичных безжелтушных форм болезни.
ХГВ у детей часто имеет доброкачественное течение с постепенной элиминацией возбудителя. Иногда на неопределенный срок сохраняется НВS-антигенемия без каких-либо клинических проявлений. Самый неблагоприятный исход ХГВ — формирование ЦП и портальной гипертензии (в 2–4% случаев).
Клиническая картина
Клинические симптомы при ХГВ включают печеночные и внепеченочные проявления. Печеночные проявления неспецифичны, встречают классические клинические синдромы: астенический, диспептический, болевой, холестаза, гепато- или даже спленомегалии (при длительном течении фиброза печени).
При хронических вирусных гепатитах наблюдают также внепеченочные симптомы: сывороточную болезнь, синдром Рейно, гломерулонефрит (ГН), узелковый полиартериит, периферическую невропатию, периферические артриты, синдром Шегрена, фиброзирующий альвеолит, миокардит, гематологические изменения — панцитопению, аутоиммунную гемолитическую анемию, лейкопению и др.
В клинической картине ХГВ у детей раннего возраста характерно отсутствие астенического синдрома и вегетативных расстройств. Диспептический и абдоминальный синдромы встречают редко. Дети активны, их физическое развитие соответствует возрасту.
У трети больных обнаруживают геморрагический синдром в виде появления мелких экхимозов, носовых кровотечений, реже — петехиальной сыпи. Желтуха нехарактерна для ХГВ (появление острой желтухи свидетельствует о суперинфекции вирусом гепатита D или другим гепатотропным вирусом). К наиболее патогномоничным внепеченочным симптомам ХГВ относят телеангиэктазии — печеночные «звездочки» и пальмарную эритему. Внепеченочные проявления ХГВ в виде геморрагического васкулита, дерматита, ГН, эндокринных нарушений, артралгий развиваются преимущественно у детей старшего возраста.
У большинства детей (90%) единственные клинические признаки заболевания при хроническом гепатите В — увеличение и уплотнение печени.
Степень активности хронического гепатита определяют тяжестью, выраженностью воспалительных изменений печени. Для оценки степени активности используют индекс Knodell («Болезни печени», см. ![]() ).
).
Диагностика
С помощью УЗИ можно выявить неспецифические эхопризнаки диффузного паренхиматозного процесса в печени и изменения гемодинамических показателей различной степени выраженности в зависимости от стадии заболевания. Стандартом лабораторной диагностики ВГВ служит определение серологических маркеров вируса.
Серологические маркеры ВГВ: HBSAg, HBEAg, anti-HBC класса IgM и IgG, anti-HBE, anti-HBS и ДНК вируса ВГВ.
В течение болезни наблюдают динамическое изменение, конверсию серологических показателей, что говорит о фазе течения заболевания (Болезни печени, серологические маркеры вируса ВГВ, см. ![]() ).
).
Выделяют две формы ХГВ: HBEAg-позитивный и HBEAg-негативный.
Для первой характерна высокая вирусная нагрузка (число вирусных копий в 1 мл крови), быстрое прогрессирование в ЦП, если не происходит сероконверсии HBEAg, что сопровождается значительным снижением степени репликации вируса, уменьшением выраженности гистологической активности и регрессом фиброза печени. При второй форме ХГВ отмечают невысокую вирусную нагрузку, умеренное повышение сывороточного уровня АЛТ и медленное прогрессирование в ЦП.
Лечение
Режим ребенка при обострении ХГВ — охранительный (постельный/полупостельный). Комплексное лечение ХГВ включает основной вариант диеты, применение ферментных препаратов, витаминов групп А и Е.
Стандартная схема лечения детей с ХГВ включает препараты интерферона-α внутримышечно или подкожно в течение 6 мес. Задача противовирусной терапии — уменьшение уровня вирусной репликации и последующая элиминация возбудителя.
Интерфероны представлены тремя группами: α, β, γ. У детей в качестве противовирусного препарата при хронических вирусных гепатитах применяют препараты интерферона α: короткоживущие и пегилированные. Помимо непосредственного противовирусного эффекта интерферон α оказывает иммуномодулирующее и антифибротическое действие.
Показания к назначению терапии интерфероном при хроническом ВГВ у детей: наличие ДНК-вируса ГВ в сыворотке крови; превышение активности АЛТ более чем в 2 раза по сравнению с нормальными показателями; наличие данных высокой гистологической активности процесса и фиброза в печеночной ткани (по результатам пункционной биопсии).
Препараты интерферона вводят внутримышечно или подкожно в дозе 5 млн МЕ/м2 3 раза в нед с оценкой эффективности терапии через 3 мес для решения вопроса о продолжении или прекращении лечения.
В терапии ХГВ используют и препараты урсодезоксихолевой кислоты, которые уменьшают холестаз, обладают мембраностабилизирущим, гепатопротективным и гипохолестеринемическим действием.
Учитывая нередкое поражение желчевыводящих путей при ХГВ, рекомендуют использовать желчегонные и спазмолитические средства.
Профилактика
Наиболее эффективный способ профилактики — вакцинация против ХГВ (см. календарь профилактических прививок). Вакцины обладают высокой иммуногенностью и вызывают продолжительный иммунитет.
Хронический гепатит С (ХГС)
Хронический гепатит С (МКБ-10: В18.2) — инфекционное заболевание печени, обусловленное персистенцией РНК-содержащего вируса, относящегося к семейству Flaviviridae.
Вирус гепатита С (ВГС) представляет собой вирус, содержащий рибонуклеиновую кислоту (РНК), размером 30–38 нм. ВГС может часто мутировать, так как репликация вирусной РНК не сопровождается коррекцией ошибок. У одного пациента в течение всего инфекционного процесса отмечают постоянное изменение генома ВГС. Выделено 7 генотипов ВГС (1a, 1b, 2a, 3a, 4, 5) и около 160 подтипов. Частота встречаемости различных генотипов HCV различна в зависимости от географической зоны: в России встречают генотипы 1b, 2, 3, генотип 1b также распространен в Канаде, США, Европе; генотипы 4 и 5 — на некоторых территориях Африки и Ближнем Востоке.
Хронический вирусный гепатит С развивается после острого гепатита С почти у 60–80% больных. Основа дифференциальной диагностики — обнаружение в сыворотке крови АТ к ВГС. Инфицирование детей ВГС чаще происходит при перинатальной передаче вируса от инфицированной матери (вертикальный путь), в раннем возрасте при парентеральных манипуляциях, лечении зубов, у подростков при внутривенном введении психоактивных препаратов и беспорядочных половых связях.
Источник HCV -инфекции — больные с клиническими проявлениями гепатита С, с бессимптомным течением, а также вирусоносители.
В структуре хронических гепатитов у детей гепатит С составляет 40,8%, в 5% ВГС сочетается с вирусом ВГВ, в 1% с вирусом гепатита G и около 1% ВГС сочетается с вирусами гепатитов В и D (Учайкин В.Ф. и др., 2012).
Для ВГС-инфекции типична высокая частота хронизации (до 80%) острой инфекции, протекающей скрыто более чем в 95% случаев.
Клиническая картина
Клинические симптомы хронического гепатита С в целом сходны с таковыми при хроническом гепатите В, однако их выраженность обычно меньше. Характерны длительное бессимптомное течение, высокая частота развития внепеченочных поражений (до 45%). Возможны небольшая гепатомегалия, интермиттирующий низкий синдром цитолиза.
Диагностика
Диагностика хронического вирусного гепатита С основана на выявлении в крови пациентов положительных АТ к вирусу — анти-HCV IgM, анти-HCV IgG, анти-NS3 IgG, анти-NS4ab IgG, анти-NS5a IgG, вирусного генома (РНК HCV) методом ПЦР.
Хронический вирусный гепатит С диагностируют на основе данных клинических, лабораторных и инструментальных методов исследования. Этиологический диагноз вирусного гепатита С ставят на основании обнаружения в сыворотке крови маркеров HCV.
HCV РНК — самый ранний маркер HCV-инфекции (обнаруживают через 14–28 дней после инфицирования) и показатель активной вирусной репликации.
Лечение
В лечении ХГС у детей можно использовать короткоживущий интерферон альфа-2а, но наибольшим эффектом обладает комбинированная терапия пэгинтерфероном альфа-2b и аналогом нуклеозидов рибавирином, которая разрешена с 3 лет.
Высокоэффективны у взрослых безинтерфероновые схемы лечения вирусного гепатита С противовирусными препаратами прямого действия. Хорошие результаты по эффективности, безопасности и достижению устойчивого вирусологического ответа показали софосбувир, ледипасвир℘, даклатасвир и рибавирин в комбинациях. В настоящее время проходят клинические исследования по применению этих схем лечения у детского контингента больных.
Прогноз
Без лечения прогноз течения ХГВ и ХГС неблагоприятный — характерно развитие ЦП, возникает необходимость в трансплантации. При эффективности противовирусной терапии прогноз для жизни и здоровья благоприятный.
Аутоиммунный гепатит
Аутоиммунный гепатит (АИГ, МКБ-10: K73.2) — прогрессирующее гепатоцеллюлярное воспаление неясной этиологии, характерное наличием перипортального гепатита, гипергаммаглобулинемии, печеночно-ассоциированных сывороточных аутоантител и положительным ответом на иммуносупрессивную терапию.
Эпидемиология
АИГ рассматривают как относительно редкую болезнь: его распространенность в Европе и США составляет 3–17 случаев на 100 тыс. населения, а ежегодная заболеваемость — 0,1–1,9 случаев на 100 тыс. В России в структуре хронических гепатитов у детей доля АИГ составляет 2,0%. Девочки и женщины составляют 75% больных. У детей АИГ обычно манифестирует в возрасте 6–10 лет.
Этиопатогенез
Под влиянием триггерных факторов [возможно вирусов — Эпштейна– Барр, кори, гепатитов А и С, а также лекарств (интерфероны)] у генетически предрасположенных лиц индуцируются Т-клеточные иммунные реакции против Аг гепатоцитов, что ведет к развитию прогрессирующих некрозно-воспалительных и фибротических изменений в ткани печени.
Классификация
В настоящее время выделяют АИГ 1-го и 2-го типов.
Роль основного аутоантигена при АИГ 1-го типа принадлежит печеночноспецифическому протеину (LSP — от англ. Liver Specific Protein). В 1984 г. McFarlane и соавт. выделили главный компонент LSP — асиалогликопротеиновый рецептор (ASGP-R), который и является мишенью аутоиммунных реакций. При АИГ 2-го типа мишень — Аг микросом печени и почек 1-го типа (LKM-1 — от англ. Liver Kidney Microsomes), основу которого составляет микросомальный фермент цитохром P-450 IID6, принимающий участие в метаболизме лекарств в организме.
АИГ 1-го типа характеризуют наличием в сыворотке антинуклеарных (ANA — от англ. AntiNuclear Antibodies) и/или антигладкомышечных (SMA — от англ. Smooth Muscle Antibody) АТ в титре ≥1:80 у взрослых и ≥1:20 у детей.
При АИГ 2-го типа в сыворотке определяют АТ к микросомам клеток печени и эпителиальных клеток клубочкового аппарата почек 1-го типа (анти-LKM-1).
На долю АИГ 1-го типа приходится более 90% всех случаев АИГ. АИГ 1-го типа встречают в любом возрасте, но чаще от 10 до 20 или от 45 до 70 лет.
АИГ 2-го типа составляет около 3–4% всех случаев АИГ, большую часть больных составляют дети от 2 до 14 лет. Заболевание может протекать тяжело, вплоть до развития фульминантного гепатита и быстрого прогрессирования до стадии ЦП.
Возможно сочетание АИГ 2-го типа с инсулинзависимым СД, витилиго и тиреоидитом. АИГ 2-го типа более резистентен к иммуносупрессивной терапии; отмена препаратов обычно ведет к рецидиву. Пациентов с клинической картиной АИГ серонегативных по АТ ANA (антинуклеарные АТ — от англ. AntiNuclear Antibodies), SMA (антигладкомышечные АТ — от англ. Smooth Muscle Antibody), anti-LKM 1 необходимо протестировать на наличие других аутоантител: anti-SLA, anti-LC1, pANCA и др.
Выделение АИГ 3-го типа большинство специалистов не поддерживают, так как его серологический маркер АТ к растворимому печеночному Аг (анти-SLA) встречают как при АИГ 1-го типа, так и при АИГ 2-го типа.
Клиническая картина
АИГ характеризуют широким спектром клинических проявлений: от бессимптомного до тяжелого, с наличием или без внепеченочных проявлений, которые могут касаться почти всех органов и систем.
В ряде случаев заболевание развивается незаметно с астеновегетативных проявлений, болей в области правого подреберья, незначительной желтухи. Иной вариант начала болезни — появление лихорадки с внепеченочными проявлениями (аутоиммунный тиреоидит, ЯК, гемолитическая анемия, идиопатическая тромбоцитопения, СД, целиакия, ГН и др.). Желтуха при этом варианте течения возникает позже.
АИГ у детей в 50–65% характерен внезапным началом и проявлением клинических симптомов, сходных с симптомами острого вирусного гепатита.
Типично для АИГ 5–10 и более кратное повышение трансаминаз сыворотки крови, признаки нарушения обмена билирубина и гиперпротеинемия за счет гипергаммаглобулинемии, обусловленной повышением IgG сыворотки, уровень щелочной фосфатазы обычно нормальный или слегка повышен, может быть повышена активность γ-глутамилтранспептидазы.
Критерии диагностики
В 1992 г. международная группа по изучению АИГ опубликовала критерии диагностики этого заболевания, выделив определенный и вероятный АИГ («Болезни печени», см. ![]() ). Диагноз определенного АИГ подразумевает наличие ряда показателей (перипортального гепатита, гипергаммаглобулинемиии, аутоантителвсывороткекрови, повышеннойактивностисывороточных трансаминаз) при нормальной концентрации церулоплазмина, меди и α1-антитрипсина. Должны отсутствовать такие признаки, как вирусные маркеры в сыворотке крови, поражение желчных протоков, отложение меди в ткани печени и другие гистологические изменения, предполагающие иную этиологию процесса, а также сведения о чрезмерном потреблении алкоголя, гемотрансфузиях в анамнезе и данные о применении гепатотоксичных лекарственных препаратов.
). Диагноз определенного АИГ подразумевает наличие ряда показателей (перипортального гепатита, гипергаммаглобулинемиии, аутоантителвсывороткекрови, повышеннойактивностисывороточных трансаминаз) при нормальной концентрации церулоплазмина, меди и α1-антитрипсина. Должны отсутствовать такие признаки, как вирусные маркеры в сыворотке крови, поражение желчных протоков, отложение меди в ткани печени и другие гистологические изменения, предполагающие иную этиологию процесса, а также сведения о чрезмерном потреблении алкоголя, гемотрансфузиях в анамнезе и данные о применении гепатотоксичных лекарственных препаратов.
Трудные диагностические случаи при небольшом количестве типичных клинических признаков, лабораторных и серологических маркеров, гистологических изменений должны быть расшифрованы с помощью балльной системы оценки признаков АИГ («Болезни печени», см. ![]() ).
).
Лечение
Иммуносупрессивная терапия у детей должна быть начата сразу после постановки диагноза АИГ, вне зависимости от клинической симптоматики.
Основа базисной иммуносупрессивной терапии АИГ — глюкокортикоиды: преднизолон, метилпреднизолон.
С целью повышения эффективности иммуносупрессии и уменьшения дозы и побочного действия глюкокортикоидов к терапии нередко добавляют азатиоприн, представляющий собой производное меркаптопурина и обладающий антипролиферативной активностью. В литературе описана терапия с применением циклоспорина, будесонида, такролимуса, циклофосфамида при АИГ, в том числе и у детей.
Цель лечения — достижение полной ремиссии не только на биохимическом, но и на морфологическом уровне. Возможность отмены иммуносупрессоров рассматривают у пациентов не ранее, чем через 24 мес после достижения биохимической ремиссии. Учитывая высокую частоту рецидива заболевания, обязательно динамическое наблюдение за пациентом с исследованием биохимических показателей (АЛТ, АСТ) 1 раз в 3 мес, иммунологических (γ-глобулинов, IgG) — 1 раз в 6 мес.
Трансплантация печени
В связи с наличием в настоящее время реальной возможности проведения трансплантации печени у детей необходима наиболее ранняя диагностика АИГ и своевременное выявление показаний к проведению трансплантации печени у детей с признаками ЦП, печеночно-клеточной декомпенсацией и развитием гепатоцеллюлярной карциномы. Прогноз трансплантации благоприятный: 5-летняя выживаемость превышает 90%.
Прогноз
Без проведения необходимого лечения АИГ имеет плохой прогноз: 5-летняя выживаемость у таких больных составляет 50%, 10-летняя — 10%.
7.5.2. Дифференциальная диагностика болезней печени у детей
При течении хронического гепатита у ребенка необходимо проведение дифференциальной диагностики с широким спектром различных, прежде всего наследственных, заболеваний: пигментных гепатозов (синдромы Жильбера, Криглера–Найяра, Дабина–Джонсона, Ротора), болезней накопления: нарушения обмена металлов (болезнь Вильсона–Коновалова, гемохроматоз), липидов (липидозы), аминокислот (фенилкетонурия, тирозинемия), углеводов (гликогенозы), лизосомные болезни (мукополисахаридозы, сфинголипидозы), митохондриальных и прочих болезней.
При болезни Вильсона (генетическая мутация в гене АТР7В, длинное плечо хромосомы 13) наблюдают избыточное накопление меди в печени, ЦНС, вовлечение в процесс органа зрения и почек. Клинически болезнь дебютирует не ранее 5 лет, вначале проявляется невысоким синдромом цитолиза (АСТ и АЛТ до 2–3 норм), неврологическая симптоматика возникает позже (на 2–3-м десятилетии жизни). При обследовании обращают внимание на повышение меди в крови, экскреции меди с мочой, снижение уровня церулоплазмина крови. Окончательно подтверждают диагноз медико-генетический анализ и пункционная биопсия печени с количественным определением меди в ткани печени. Необходимы консультации невролога (экстрапирамидная симптоматика) и офтальмолога (кольцо Кайзера–Флешнера). В терапии используют хелаты (пеницилламин) и препараты цинка.
При гликогеновой болезни вследствие энзимного дефекта гликоген избыточно накапливается в различных органах и тканях — печени, почках и мышцах. Наиболее выражено поражение печени при I и IV типах болезни. Характерно быстрое развитие ЦП и печеночной недостаточности. Затем присоединяется мышечная атрофия и тяжелая кардиомиопатия. Характерный морфологический признак — обнаружение «гликогеновых телец» в гепатоцитах. Прогноз неблагоприятный, единственный метод лечения — трансплантация печени.
При синдроме Жильбера (самый распространенный тип врожденной негемолитической неконъюгированной гипербилирубинемии, обнаруживаемый у 5–10% населения, преимущественно среди мужского пола) нарушен переход билирубина через клеточную мембрану, частично нарушена глюкуронизирующая функция печени. Характерны рецидивирующая умеренная желтуха, усиливающаяся под влиянием триггерных факторов; увеличение неконъюгированной фракции билирубина при биохимическом исследовании. Для уменьшения степени гипербилирубинемии используют препараты фенобарбитала. Прогноз болезни благоприятный.
Патогенез синдрома Криглера–Найяра связан с дефектом энзимной системы глюкуронилтрансферазы: при 1-м типе наблюдается полный дефект фермента уридиндифосфат-глюкуронилтрансферазы, при 2-м типе — неполный дефект. Отличительная лабораторная особенность — уровень свободной фракции билирубина выше 300–340 мкмоль/л при полном отсутствии конъюгированного билирубина. В результате ранней гипербилирубинемии развивается классическая билирубиновая энцефалопатия, в большинстве случаев летальная. Для диагноза и лечения используют препараты фенобарбитала. При угрозе развития билирубиновой энцефалопатии показаны сеансы заменного переливания крови, фототерапии, холестирамина℘ внутрь.
Первично-билиарный цирроз (ПБЦ) – это медленно-прогрессирующее аутоиммунное заболевание печени, встречающееся чаще у женщин старше 25 лет. Характеризуется воспалением портальных трактов и разрушением внутрипеченочных желчных протоков. В лечении используются препараты урсодезоксихолиевой кислоты длительно.
7.5.3. Цирроз печени
МКБ-10: K74 (Цирроз печени)
Цирроз печени (ЦП) — прогрессирующее заболевание, проявляемое диффузным склерозированием, перестройкой нормальной архитектоники печени с узловой трансформацией и образованием внутрипеченочных сосудистых анастомозов.
Диагностика
Методы диагностики фиброза печени и ЦП различны по информативности и инвазивности.
Косвенные биохимические показатели фиброза печени. В настоящее время не существует специальных лабораторных сывороточных тестов для точного определения промежуточных стадий фиброза. Доказано, что широкодоступные для определения в клинической практике аминотрансферазы (АЛТ, АСТ) не отражают тяжести гистопатологических изменений в печени. За последние годы с целью определения активности фиброгенеза в печени был предложен ряд диагностических панелей, включающих некоторые биохимические показатели и острофазовые белки (ФиброТест и АктиТест).
«Золотым стандартом» диагностики фиброза печени до недавнего времени оставалась пункционная биопсия печени.
Степень выраженности гистологической активности и стадию фиброза печени принято определять в цифровом эквиваленте в соответствии со специальными полуколичественными шкалами (Knodell, Ishak, METAVIR, Desmet). В условиях практической педиатрии пункционную биопсию печени рекомендуют выполнять только в том случае, если иные неинвазивные методы исследования не позволяют установить точный диагноз и выраженность структурных изменений печени.
Методами диагностики патологии печени у детей служат различные способы визуализации (УЗИ, КТ, спиральная КТ, МРТ, магнитно-резонансная эластография печени). Особенное распространение среди неинвазивных методов получила фиброэластометрия печени, позволяющая быстро оценить стадию фиброза печени (от F0 — «нет фиброза» до F5 — «ЦП»).
Лечение
При компенсированном ЦП необходимо своевременно проводить верификацию диагноза и как можно раньше начинать этиотропную терапию, если таковая существует. Есть и общие принципы терапии ЦП у детей. Пациентам с наличием асцита показано уменьшение в рационе соли до 2 г в сут и назначение диуретиков, а в случае отсутствия положительной динамики проводят внутривенное введение альбумина человека. С целью профилактики кровотечений из варикозно расширенных вен пищевода применяют пропранолол, а в случаях острого кровотечения проводят бандажирование, эндоскопическую склеротерапию или лигирование варикозных вен. Для профилактики и лечения печеночной энцефалопатии в рационе снижают долю белка до 1,0–1,5 г/кг массы тела в сут, а также используют препараты лактулозы. При декомпенсации ЦП детям проводят трансплантацию печени.
Тестовые задания
Ответы: 1 — a; 2 — a; 3 — b; 4 — a; 5 — a; 6 — a.
Ситуационная задача
На приеме у педиатра мальчик 7 лет с жалобами на слабость, снижение аппетита, боли в животе в околопупочной области.
Общий осмотр: кожа бледная, отмечена субиктеричность склер и слизистых ротовой полости, полилимфаденопатия. При пальпации живота болезненность в эпигастральной области, точке Кера. Печень +1,5 см, чувствительная, край печени гладкий, закруглен. Размеры печени по Курлову: 10–8,5–6 см. Селезенка не пальпируется. Стул оформлен, нормальной окраски, со склонностью к запорам до 3 дней, без патологических примесей.
При лабораторном обследовании:
Иммунологические показатели: СРБ 12 мг/л, HВSAg+, HВEAg+, анти-HВcor IgG — положительно, ДНК вируса ВГВ+.
Ответы: 1 — b; 2 — b.