РОССИЙСКОЕ РЕСПИРАТОРНОЕ ОБЩЕСТВО
РЕСПИРАТОРНАЯ МЕДИЦИНА
Респираторная медицина: руководство: в 3 т. / под ред. А. Г. Чучалина. — 2-е изд., перераб. и доп. — М.: Литтерра, 2017. — Т. 2. — 544 с.: ил. ISBN 978-5-4235-0263-8 (т. 2) |
Руководство
Под редакцией академика РАН А.Г. Чучалина
2-е издание, переработанное и дополненное
Том 2
Посвящается памяти Сергея Петровича Боткина

Москва
Издательство «Литтерра»
2017
УДК 616.2
ББК 54.12
Р43
01-УПС-2801
Р43
Респираторная медицина: руководство: в 3 т. / под ред. А. Г. Чучалина. — 2-е изд., перераб. и доп. — М.: Литтерра, 2017. — Т. 2. — 544 с.: ил.
ISBN 978-5-4235-0263-8 (т. 2)
ISBN 978-5-4235-0273-7 (общ.)
Во втором томе руководства представлены клинические разделы, посвященные инфекционным поражениям дыхательных путей и легких, онкологическим заболеваниям, болезням и аномалиям сосудов легких, заболеваниям плевры и средостения. Также во втором томе размещен раздел о особенностях легочных заболеваний при беременности.
Издание рассчитано на широкий круг специалистов: терапевтов, пульмонологов, фтизиатров, аллергологов и других специалистов разной степени квалификации и подготовки. Второй том актуален для инфекционистов, онкологов, сосудистых хирургов, акушеров-гинекологов, торакальных хирургов.
Изучение руководства позволит врачам достичь высокого уровня компетенции и будет способствовать решению сложнейших вопросов клинической практики.
УДК 616.2
ББК 54.12
Права на данное издание принадлежат ООО «Издательство «Литтерра». Воспроизведение и распространение в каком бы то ни было виде части или целого издания не могут быть осуществлены без письменного разрешения ООО «Издательство «Литтерра».
ISBN 978-5-4235-0263-8 (т. 2)
ISBN 978-5-4235-0273-7 (общ.)
12.1. Плевральный выпот
А.Г. Чучалин, Я.Н. Шойхет, Е.А. Цеймах
Введение
Проблема плеврального выпота привлекает внимание практических врачей и научных работников вследствие относительно широкого распространения, большого количества причин, сложности дифференциальной диагностики и необходимости обеспечения адекватного лечения в зависимости от характера процесса, его патогенеза и особенностей течения [1–3].
В последние годы в области физиологии и патофизиологии плевральной полости получены новые данные, существенно изменившие представления о механизмах, лежащих в основе формирования плеврального выпота [4, 5].
Плевральная полость ограничена висцеральной плеврой, покрывающей легкое, и париетальной плеврой, покрывающей грудную стенку и диафрагму. Париетальная плевра делится на шейную, костальную (или реберную), диафрагмальную и медиастинальную, соответственно выстилаемым поверхностям. Между листками плевры имеется узкое пространство, в норме содержащее небольшое (до 0,3 мл/кг) количество жидкости. Эта жидкость имеет низкое онкотическое давление, содержание белка в ней примерно 10 г/л. Жидкость и белки попадают внутрь этого пространства из системного кровотока и удаляются лимфатической системой париетальной плевры. Множество факторов влияет на эти процессы, включая гидростатическое и онкотическое давление, дыхательные движения и силу тяжести. Но основным считается степень абсорбции и оттока жидкости по пристеночной плевральной лимфатической системе. В нормальных условиях ток лимфы по ней составляет 0,1–0,15 мл/кг в час, но может увеличиваться до 30 мл/ч (около 700 мл/день) у человека средней комплекции. Когда продукция жидкости превосходит указанные возможности плевры по реабсорбции, происходит ее накопление.
Плевральное давление ниже атмосферного, что способствует раздуванию легкого. Из-за проницаемости мезотелия избыток жидкости движется в эту область низкого давления и накапливается в виде плеврального выпота. Последний может иметь различную этиологию и сформироваться в результате поражения как самих плевральных мембран, так и заболеваний органов грудной клетки или брюшной полости.
Плевра: строение и функция
Толщина субмезотелиального интерстиция как париетального, так и висцерального листков плевры составляет приблизительно 20 мкм. Однако толщина самих листков плевры значительно различается. Париетальный листок плевры в 5 раз толще, чем висцеральный. Кроме того, он содержит лимфатические стоматы (поры, люки). К особенностям париетальной диафрагмальной плевры относятся трансдиафрагмальные лимфатические связи, которые обеспечивают переток некоторой части жидкости с брюшины к плевре. В норме плевральное пространство 18–20 мкм шириной, хотя в наиболее критических местах расширяется. Вероятно, первичная функция плевральных мембран — способствовать широкому движению легкого по отношению к грудной стенке. Если легкое подпаяно прямо к грудной стенке, его расправление и сдувание будет несколько ограничено. Тем не менее в клинических и экспериментальных исследованиях облитерация полости плевры не была ассоциирована с большими нарушениями функции легкого [6, 7]. Наиболее часто снижался объем легкого на пораженной стороне, в одном из исследований — также и объем противоположного легкого [7, 8]. Если облитерация полости плевры сочетается с утолщением плевры, то изменения функции легкого могут происходить более из-за фиброторакса, чем из-за облитерации плевральной полости. Висцеральная плевра дает также механическую поддержку легкого, способствуя поддержанию его формы, сдуванию легкого, а также ограничивая его раздувание [9, 10]. Недавно выявлена еще одна функция плевральной полости: это путь, по которому отечная жидкость может покинуть легкое [11], что позволит избежать отек легких [12–14]. Так, причиной транссудата при застойной сердечной недостаточности является выход отечной жидкости из легкого в пространство, где ее влияние на функцию легкого относительно мало [15].
Существует пять плевропульмональных образований (compartments), которые рассматривают с позиций их анатомической организации: париетальная система микроциркуляции; париетальное интерстициальное пространство; плевральная полость; легочный интерстиций; микроциркуляторное ложе висцеральной плевры.
Формирование полости плевры, перикарда, брюшины начинается на 3-й неделе эмбрионального развития, и разделение их происходит на 9-й неделе [16]. Различные кисты, дивертикулы и дефекты могут произойти в результате неполного разделения этих трех мезодермальных пространств. Плевральные мембраны покрыты одним слоем мезотелиальных клеток, которые бывают различной формы, от кубических до плоских, возможно, в зависимости от степени растяжения подлежащей субмезотелиальной ткани. Эти клетки секретируют макромолекулярные компоненты внеклеточного матрикса и организуют его в зрелый матрикс, частицы фагоцитоза, фибринолитические и прокоагулянтные факторы, факторы хемотаксиса нейтрофилов и моноцитов, что может быть важно для мобилизации воспалительных клеток в плевральную полость [17–20], а также цитокины: трансформируемый ростовой фактор-бета (transforming growth factor-β), эпидермальный ростовой фактор (epidermal growth factor), тромбоцитарный ростовой фактор (platelet-derived growth factor), играющие важную роль в плевральном воспалении и фиброзе [21].
Мезотелиальные клетки относятся к числу тех, которые вовлекаются в воспалительный процесс, особенно если он переходит на поверхность плевры. Миграция нейтрофилов в плевральную полость осуществляется под действием некоторых химокинов, к которым, в частности, относится ИЛ-8. Высокая концентрация последнего наблюдается у больных с эмпиемой плевры. Местом синтеза этого цитокина являются вовлеченные в воспалительный процесс мезотелиальные клетки и их ворсинки. Определение содержания ИЛ-8 оказалось чувствительным тестом при проведении химиотерапии и оценке ее эффективности у больных с мезотелиомой. Его рассматривают как биомаркер в дифференциальной диагностике воспалительных и канцерогенных процессов [22].
Мезотелиальные клетки имеют толщину около 4 мкм, связаны между собой у поверхности плевры плотными соединениями, у базальной части клеток они соединены в виде адгезивного межклеточного контакта. На поверхности мезотелиальных клеток имеются микроворсинки, которые неравномерно распределены по поверхности плевры. Ворсинки продуцируют большое количество гликопротеинов и гиалуроновой кислоты. Совсем недавно описан феномен формирования сурфактанта на поверхности микроворсинок. Они окружены фосфолипидами, которые собраны в кольцевую форму, то есть по своей морфологической характеристике напоминают альвеолярный сурфактант. Эти новые открытия проливают свет на взаимодействие обоих листков плевры и объясняют легкость скольжения поверхностей париетального и висцерального листков. Также они увеличивают площадь поверхности для метаболической активности и играют роль в фагоцитозе.
Мезотелиальные клетки продуцируют гиалуроновую кислоту, экспрессируют микрофиламенты кератина, окрашиваются негативно с антителами, специфичными к эпителию (Ber-EP4, B72.3, Leu. M1, CEA), и окрашиваются позитивно для калретинина и мезателина, что важно для гистохимической и иммуногистохимической идентификации клеток в плевральном выпоте [23]. Клетки лежат на тонкой базальной мембране над соединительной тканью, содержащей в основном коллаген и эластин. В висцеральной плевре больше коллагена по отношению к эластину, чем в паренхиме легкого, что соотносится с ее ролью механического покрытия [24, 25]. В соединительнотканном слое под висцеральной плеврой также проходят кровеносные и лимфатические сосуды, и он далее сливается с соединительной тканью легкого [24]. Этот слой содержит различные факторы роста, что важно для регенеративных процессов [26].
Париетальная плевра получает артериальный приток из межреберных артерий и дренируется в межреберные вены. Висцеральная плевра кровоснабжается из бронхиальных артерий и дренируется в легочные вены. От висцеральной плевры отток осуществляется в венозную систему с более низким давлением.
Лимфатическая система обеспечивает дренаж экстраплеврального париетального интерстиция и плевральной полости, в которую открыты лимфатические стоматы (поры, люки) диаметром 1–40 мкм, которые связаны напрямую с пристеночными париетальными лимфатическими сосудами и сформированы прерыванием мезотелиального слоя там, где мезотелий прилежит и соединяется с подлежащим лимфатическим эндотелием [27, 28]. Они связывают плевральное пространство с лимфатической системой париетальной плевры, могут собираться группами, образуя кластеры и располагаясь субмезотелиально в виде лакун. Стомата может вместить частицы до размера эритроцита. На вдохе эти поры способны растягиваться, и их архитектура устроена таким образом, что они формируют функциональные односторонние клапаны. Они являются основной системой для выведения плевральной жидкости [29]. Известна их способность удалять и плотные частицы, в том числе клеточные элементы. Жидкость оттекает в лимфатические лакуны, которые затем дренируются по межреберным лимфатическим сосудам в парастернальные или парааортальные лимфоузлы, в грудной лимфатический проток и в венозную систему. Висцеральная плевра имеет широкую лимфатическую сеть, но она не соединяется с плевральной полостью [29]. Лимфоидные клетки располагаются в пределах агрегатов, формирующих локусы Кампмейера, которые могут иметь иммунную функцию [20, 30].
Белковые соединения реабсорбируются через поры мезотелиального покрова париетального листка брюшины.
Только париетальная плевра имеет чувствительные нервные волокна из межреберных и диафрагмальных нервов. Центральный диафрагмальный отдел иннервируется диафрагмальным нервом, и боль там воспринимается как на ипсилатеральном плече, иногда как ощущение диспноэ [31]. Кроме того, эти нервные волокна могут участвовать в формировании болевого синдрома после торакатомии и плевродеза [32]. Висцеральная плевра не содержит чувствительных нервных волокон, и боль из-за воспаления, опухоли или катетера, введенного далеко в легкое во время бронхоскопии, локализуется в области прилежащей париетальной плевры.
Физиология плевральной полости
Движение жидкости и белка в плевральной полости
В старой модели давление жидкости в плевральной полости рассматривалось как результирующая величина силы, направленной на инспирацию, и эластической силы легких, направленной на экспирацию, а также капиллярного и онкотического давлений в мембранах висцерального и париетального листков плевры и онкотического давления самой плевральной жидкости. В этой модели предполагалось, что фактор давления обеспечивает движение жидкости в плевральной полости от париетального к висцеральному листку, а затем в легочный интерстиций.
Подобная схема строилась на экспериментальных данных, полученных на животных, у которых тонкая мембрана висцеральной плевры и пониженное давление в капиллярах, так как они входят в систему ЛА. Позже было установлено, что у человека капиллярное давление в висцеральной плевре достаточно высоко, так как кровоснабжение осуществляется из системного кровотока. Starling и Tubby интерпретировали образование плевральной жидкости с растворенными в ней химическими соединениями как итог взаимодействия гидравлического и коллоидно-осмотического давления. Это положение сохраняет свою силу и в настоящее время, особенно оно касается обмена воды, которая проникает через биологические мембраны значительно проще, чем растворенные химические соединения, а также белки плазмы крови. Современная модель транскапиллярного движения жидкости достаточно проста. Жидкость фильтруется в конечной части артериол, переходящих в капиллярную сеть. Реабсорбция ее осуществляется в начальной части венул. В последние 10–20 лет был достигнут консенсус, что в норме плевральная жидкость формируется в результате перетока жидкой составляющей крови из системных плевральных сосудов плевральных листков через проницаемые плевральные мембраны в плевральную полость и выводится оттуда по лимфатической системе париетальной плевры [22, 33, 34]. Процесс образования фильтрата происходит в апикальных отделах париетальной плевры. Омывая плевральную полость, жидкость достигает диафрагмальной и медиастинальной частей париетальной плевры, то есть мест, где производится ее реабсорбция через стоматы, расположенные исключительно на париетальном листке преимущественно медиастинальной и диафрагмальной поверхностей. В физиологических условиях висцеральная плевра в фильтрации плевральной жидкости не участвует (рис. 12.1).
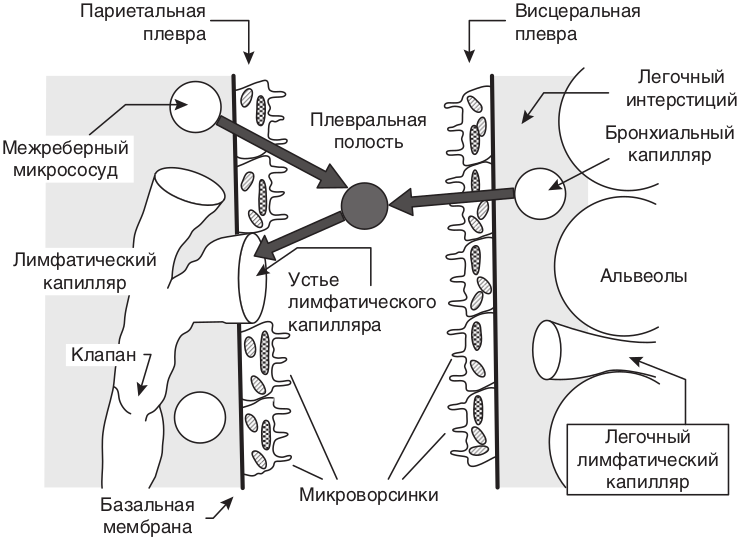
Для указанного процесса движения жидкости необходим ряд физиологических условий.
-
Небольшой объем жидкости, который фильтруется и поступает в плевральную полость.
-
Субатмосферное давление (необходимое для выполнения дренажной функции лимфатической системы париетальной плевры). Биофизический процесс генерации субатмосферного давления достигается за счет функционирования лимфатической системы и играет одну из ключевых ролей во всем процессе обмена плевральной жидкости. Внутриплевральное давление ниже давления в интерстициальной ткани. Градиент между ними не зависит от размера плеврального пространства. Плевральные мембраны имеют отверстия, через которые свободно перемещаются вода и белок [35–38]. Не доказана роль в реабсорбции плевральной жидкости мезотелиальных клеток [39, 40].
-
Отверстия в мезотелиальном слое могут обеспечить градиент бикарбоната между плевральной жидкостью и плазмой, что ведет к пассивному распределению ионов через полупроницаемую мембрану.
-
Выход жидкости в плевральную полость происходит медленно и коррелирует с расходами ее в интерстициальной ткани [41, 42].
-
Концентрация белка в плевральной жидкости низкая и предполагает его прохождение через мембрану благодаря градиенту высокого давления.
-
Бо́льшая часть жидкости выходит из плевральной полости по лимфатическим стомам, а не путем диффузии или активного транспорта [24].
Лимфатическая активность носит пульсирующий характер, обусловлена ритмом сокращения гладких мышц лимфатических сосудов (внутренняя активность) и частично зависит от осцилляционного давления тканей грудной клетки в период респираторного цикла (внешняя активность).
Для ориентира в оценке плевральной жидкости целесообразно использовать нормальные показатели клеточных и других параметров. Плевральная жидкость в норме имеет следующие параметры: общий объем 0,1–0,2 мл/кг; количество клеток в 1 мл 1000–5000, мезотелиальных клеток 3–70%, моноцитов 30–75%, лимфоцитов 2–30%, гранулоцитов 10%; белок 10–20 г/л, альбумин 50–70%; уровень глюкозы соответствует таковому в плазме, ЛДГ менее 50% уровня в плазме; pH не ниже уровня в плазме.
Плевральное давление
Внутриплевральное давление изменяется приблизительно на 0,5 см вод.ст. на 1 см высоты [43]. Такой вертикальный градиент давления подразумевает, что плевральная жидкость не образует статический столб, но медленно течет от вершины к основанию плеврального пространства. Плевральное давление у человека приблизительно –5 см вод.ст. в середине грудной клетки при функциональном остаточном объеме и –30 см вод.ст. при полном легочном объеме [44]. Если легкое менее эластично, при этих объемах данные давления будут сдвинуты в отрицательную сторону.
Давление в плевральной полости субатмосферное. Если интерстициальная ткань легких находится под действием субатмосферного давления, то в ней происходит накопление белковых образований. В плевральной же полости в физиологических условиях достаточно стабильно содержание белка и других биологических и химических соединений.
Хотя давление в плевральной полости ниже атмосферного, газы там не накапливаются. Объяснение кроется в разнице суммы давлений газов капиллярной крови и плеврального давления. Сумма всех частичных давлений газов в капиллярной крови около 700 мм рт.ст., или почти на 60 мм рт.ст. ниже атмосферного (в то время как плевральное давление достигает лишь –30 см вод. ст. при полном вдохе). Это помогает поддерживать плевральную полость свободной от газов и/или способствовать абсорбции попавших туда газов [5, 22].
Патофизиология плевральной полости
Плевральный выпот
Определение
Плевральный выпот — патологический синдром накопления жидкости в плевральной полости при плевральных, пульмональных или экстрапульмональных заболеваниях, когда продукция жидкости из системного кровотока превосходит возможности реабсорбции ее по пристеночной плевральной лимфатической системе, что обусловлено понижением онкотического давления; повышением давления в легочных сосудах и проницаемости плевральных листков; обструкцией путей лимфатического оттока; снижением отрицательного интраплеврального давления.
Чтобы накопился выпот в плевральной полости, необходимо увеличение проникновения туда жидкости или уменьшение выведения жидкости оттуда более чем в 30 раз [16]. При поиске причины выпота в первую очередь обращают внимание на процессы, приводящие к увеличению поступления жидкости в плевральную полость (табл. 12.1).
| Патофизиологический процесс | Особенности течения болезней |
|---|---|
Чрезмерное образование и секреция транссудата (20–30 мл в норме) с увеличением гидростатического давления |
Повышенное венозное и капиллярное давление при кардиальном застое, например при недостаточности левых отделов сердца |
Сниженное онкотическое давление (гипоальбуминемия) |
Нефротический синдром, например при хроническом пиелонефрите или недоедании |
Нарушение физиологической реабсорбции плевральной жидкости |
Шварты (постинфекционные), плевральные карциномы, туберкулез, перитонеальный диализ |
Снижение отрицательного давления в плевральной полости |
Ателектаз (обструкции) |
Увеличение проницаемости или поражение интраторакального сосудистого русла |
Плеврит, эмпиема, опухоль, травма или ятрогения |
Спонтанный травматический или ятрогенный разрыв грудного протока с обструкцией лимфооттока |
Хилоторакс |
Увеличение трансдиафрагмального дренажа жидкости из брюшной полости или забрюшинного пространства, дефект мембраны, рост торкоабдоминального градиента давления |
Интраабдоминальный абсцесс, панкреатит, длительный асцит, обструктивная нейропатия, перитонеальный диализ |
При ряде заболеваний основной причиной накопления жидкости будет нарушение ее оттока. Выход жидкости из плевральной полости бывает снижен из-за обструкции стомата, снижения пропульсивной способности лимфатических сосудов, инфильтрации лимфоузлов, дренирующих плевральную полость, или увеличения системного венозного давления (табл. 12.1).
Снижение лимфооттока было подтверждено у больных туберкулезом и выпотом на фоне злокачественных опухолей [45]. Среди причин плеврального выпота выделяют первичные и вторичные процессы.
Классификация причин плеврального выпота
У больных ЛГ с признаками правожелудочковой недостаточности скопления жидкости в плевральной полости не происходит, так же как и у больных с хроническим легочным сердцем в стадии правожелудочковой недостаточности. Скопление транссудата в плевральной полости ассоциируется с дисфункцией левого желудочка и развитием клинических признаков застойной сердечной недостаточности. Возникновение этого клинического феномена связывают с повышением давления в легочных капиллярах и большим объемом крови в легких, что приводит к пропотеванию транссудата через поверхность висцеральной плевры в ее полость [7, 46]. Удаление транссудата из плевральной полости посредством торакоцентеза снижает объем циркулирующей жидкости (крови) и давление в легочных капиллярах, поэтому в современные лечебные рекомендации он включен как обязательная процедура при ведении больных с застойной сердечной недостаточностью. При экссудативном плеврите другие закономерности лежат в основе появления и накопления экссудата, это происходит вследствие возрастающего потока белков и форменных элементов крови в плевральную полость, что может рассматриваться как увеличенное в объеме тканевое пространство (серозной полости).
Выпот классифицируется как экссудат и транссудат [47]. Транссудат формируется попаданием жидкости через интактный барьер (непораженные плевральные мембраны) благодаря увеличению гидростатического или снижению осмотического давления. Экссудат накапливается благодаря поступлению жидкости и белка через поврежденный барьер с повышенной проницаемостью.
Влияние плеврального выпота на функцию легкого
Для понимания влияния плеврального выпота на легочную функцию необходимо оценить воздействие сил, возникающих при дыхании и на него влияющих. В присутствии занимающей пространство жидкости в плевральной полости легкое создает силу, тянущую внутрь, грудная клетка — наружу, диафрагма — вниз. Если легкие и грудная клетка имеют нормальную эластичность, легочный объем уменьшается приблизительно на 1/3 объема плеврального выпота, гемиторакс увеличивается на оставшиеся 2/3. Если легкое нормальное, то нет признаков значительной гипоксемии, предположительно потому что вентиляция и перфузия уменьшаются одинаково.
Диагностика плеврального выпота
Признаки плеврального выпота:
Частыми симптомами у больных с выпотом являются боль в грудной клетке, непродуктивный кашель и диспноэ, одышка. Эти симптомы имеют разные причины. Боль в грудной клетке возникает из-за воспаления париетальной плевры. Иногда этот симптом сопровождается слышимым или пальпируемым шумом трения плевры, отражающим движение ненормальных плевральных тканей. Кашель возникает благодаря сдавлению легкого, так же как при коллапсе легкого в результате пневмоторакса. Диспноэ, скорее всего, является результатом механической неэффективности дыхательных мышц, которые растянуты за счет выбухания грудной стенки наружу из-за выпота и диафрагмы вниз. После удаления большого количества выпота диспноэ проходит быстро, хотя уменьшение объема плевральной жидкости ассоциировано лишь с небольшим увеличением легочного объема и некоторым увеличением или даже уменьшением парциального давления кислорода. Это связано с возможностью произвести более отрицательное плевральное давление при дыхательной экскурсии после торакоцентеза из-за улучшенной механической эффективности дыхательных мышц [5].
Анамнез (острое или хроническое заболевание — медицинская документация)
Начало болезни:
Объективное обследование включает определение зоны тупости, снижения голосового дрожания, ослабления везикулярного дыхания. Дополнительными признаками являются асимметричная грудь, расширение межреберных пространств.
Возможность плеврального выпота должна предполагаться всегда при обследовании больного с патологической рентгенограммой грудной клетки. Повышенная «плотность» на рентгенограмме грудной клетки часто приписывается паренхиматозным инфильтратам, хотя это может быть признаком плевральной жидкости. Свободная жидкость в плевральной полости под действием силы тяжести находится в задней реберно-диафрагмальной борозде в вертикальном положении больного. Таким образом, если задний ребернодиафрагмальный угол затемнен или задняя часть диафрагмы не видна на боковой рентгенограмме, показаны боковые рентгенограммы лежа на боку с обеих сторон или УЗИ для оценки присутствия плевральной жидкости. Если расстояние между грудной стенкой и легким менее 10 мм, плевральный выпот не является клинически значимым, и в любом случае будет трудно получить жидкость с помощью торакоцентеза. Если оно более 10 мм, необходимы исследования для установления причины плеврального выпота [3, 5].
Критерии классификации плеврального выпота:
Диагностика заболеваний плевры по плевральной жидкости (рис. 12.2):
-
признаки плевропатии при объективном исследовании и визуализации;
-
локализация, объем и характер изменений плевры — объективное исследование и визуализация (смещение средостения, при парапневмоническом плеврите — в здоровую сторону; при ателектазе, пневмоциррозе — в пораженную);
-
субстрат в плевральной полости (воздух, жидкость) — визуализация и пункция;
-
причины заболеваний плевры — анамнез, объективное обследование, визуализация, лабораторное исследование, биопсия.
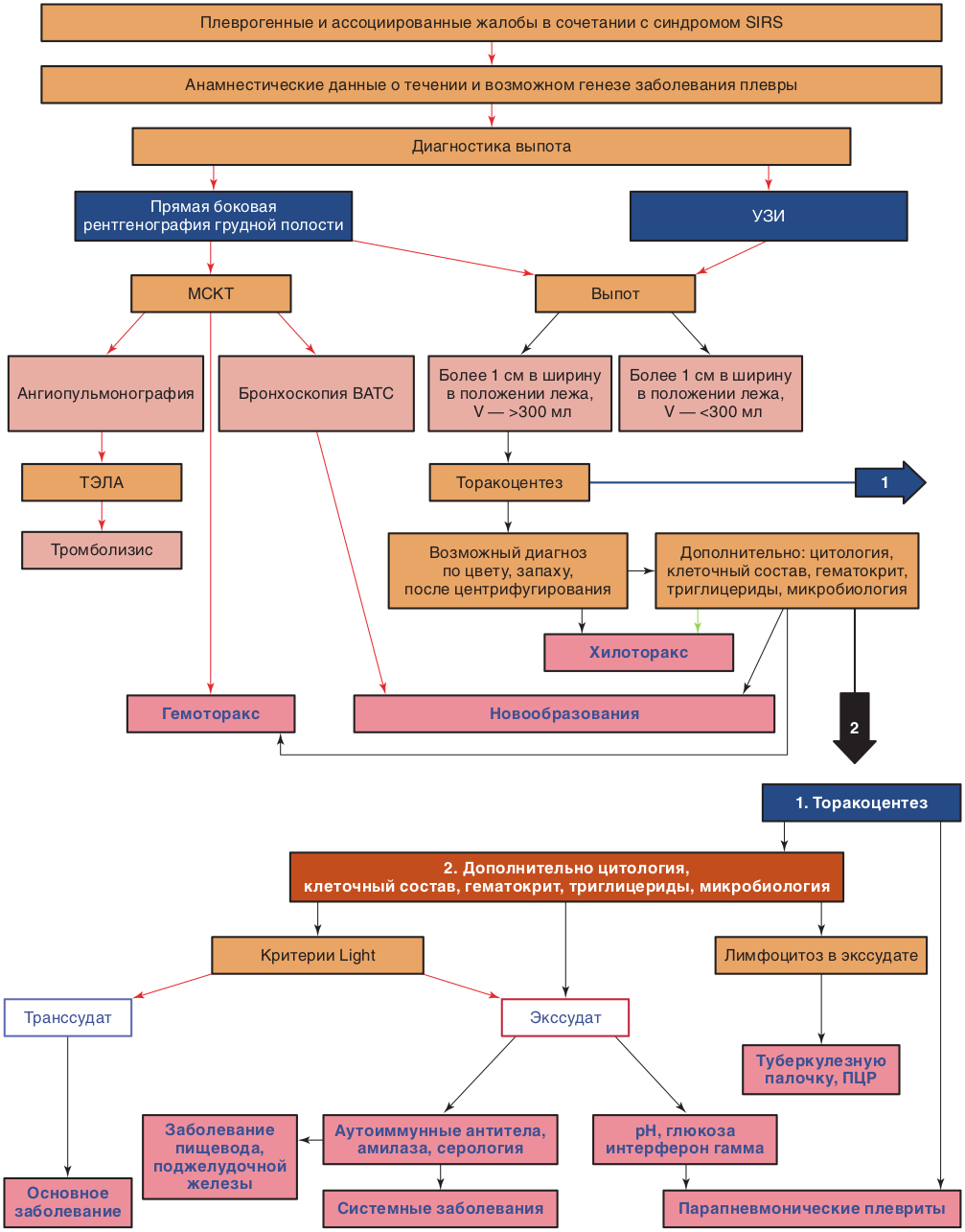
Методы диагностики:
Дифференциальная диагностика плеврального выпота
Перед клиницистами часто встает вопрос о дифференциальной диагностике характера выпота в плевральную полость. Диагностическая программа основана на определенных принципах, исходящих, во-первых, из того, что наличие плеврального выпота — это определенный симптомокомплекс, указывающий на осложнение в течении болезни; во-вторых, из того, что необходимо определить характер самого выпота (транссудат или экссудат). Определение характера выпота значительно упрощает решение вопроса о нозологической принадлежности патологического процесса в плевре и плевральной полости. Однако следует указать на то, что и при использовании современных методов диагностики не всегда удается поставить этиологический диагноз. По оценке некоторых авторов, частота диагноза «плеврит неустановленной этиологии» порой достигает 20% [5].
Множество заболеваний может сопровождаться плевральным выпотом (табл. 12.2). В первую очередь необходимо отдифференцировать экссудат от транссудата [3, 5, 48].
Транссудат |
Экссудат |
|
заболевания |
внешние воздействия |
|
|
Злокачественные новообразования:
Инфекционные заболевания:
Желудочно-кишечные заболевания:
Коллагенозы:
Синдром после повреждения сердца (Дресслера). Синдром после аортокоронарного шунтирования. Асбестоз. Саркоидоз. Уремия. Синдром Мейгса. Синдром гиперстимуляции яичников. Синдром «желтых ногтей». Фиксированное легкое. Гемоторакс. Хилоторакс |
|
Подавляющее большинство транссудатов связано с застойной сердечной недостаточностью и циррозом печени [3], а 90% экссудативных плевральных выпотов обусловлены злокачественными новообразованиями, метастазами, пневмонией, заболеваниями желудочно-кишечного тракта, ТЭЛА.
Диагностический торакоцентез
Диагностический торакоцентез должен быть выполнен практически у каждого больного со свободной жидкостью, занимающей более 10 мм на снимке лежа на боку [3]. Если у больного явная сердечная недостаточность, то следует провести ее лечение и временно отложить процедуру. С другой стороны, если у такого больного фебрильная гипертермия и/или боль в грудной клетке, и/или выпот с одной стороны значительно больше, чем с другой, то торакоцентез должен быть выполнен без задержки. Даже при наличии коагулопатии, тромбоцитопении и у больных на механической вентиляции с положительным давлением он может быть без особого риска выполнен тонкой иглой. Важны правильное положение больного, идентификация уровня и локализации жидкости, адекватная местная анестезия, введение иглы по верхнему краю ребра (рис. 12.3).
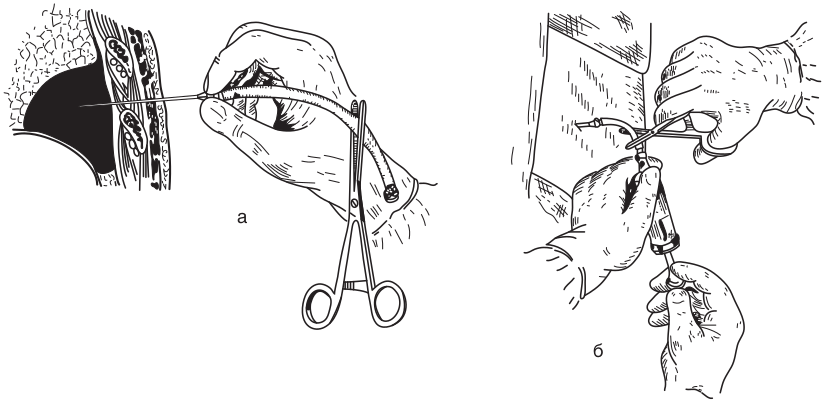
Наиболее безопасным местом пункции для получения выпота является четвертое-пятое межреберье по переднеподмышечной линии. Необходимо избегать введения иглы медиальнее срединно-ключичной линии [49]. Лучшие результаты могут быть достигнуты при намеченной точке пункции под рентгенологическим и УЗ-контролем, особенно если выпот отграничен. Предпочтительное положение больного — сидя и слегка наклонившись, опершись на столик перед собой. Вкол в кожу производится ниже межреберья с проведением иглы в межреберье у верхнего края нижележащего ребра для создания непрямого канала и исключения связи плевральной полости с внешней средой после извлечения иглы.
После проникновения в плевральную полость пробно аспирируется немного плевральной жидкости для контроля. И после уверенности в достижении иглой экссудата, тонкая игла удаляется, на ее место аналогичным образом вводится более толстая для проведения аспирации. Не рекомендуется удалять за один раз более 1 л жидкости (даже при отсутствии эмпиемы и фибринозных наложений) из-за риска развития отека легкого на фоне его расправления. Осложнения торакоцентеза — пневмоторакс (от 2 до 6%) и гемоторакс (1%). Риск выше у больных после лучевой терапии и предшествующих множественных торакоцентезов. Дренирование плевральной полости при пневмотораксе требуется только в половине случаев [51]. При малых гидротораксах и множественных его локализациях, буллезной болезни легких плевральную пункцию можно производить под контролем УЗИ [49, 50].
На основании исследования плеврального выпота, полученного при торакоцентезе, необходимо решить, является он транссудатом или экссудатом [3, 47].
Наиболее значимые клинико-лабораторные параметры:
Исследования плеврального выпота
Исследования плеврального выпота включают оценку физических свойств, клинико-лабораторный и биохимический анализы, бактериологическое, цитологическое и иммуноцитохимическое исследования.
Внешний вид жидкости. Макроскопический вид и запах. Зловонный запах свидетельствует о бактериальной инфекции, возможно анаэробного характера, запах мочи — об уринотораксе. Супернатант плевральной жидкости исследуют на липиды, если он мутный, молочнообразный или кровянистый. Осадок — на кристаллы холестерина.
Макроскопически следует оценить цвет, окраску, прозрачность до и после центрифугирования, осадок, запах, что поможет в ориентации на ассоциированное с выпотом заболевание (табл. 12.3).
Свойства плеврального выпота |
Ассоциированные заболевания |
|||
цвет |
палесценция |
консистенция |
запах |
|
Желтый, цвет сена, вплоть до янтарного |
Нет |
Водянистая |
Отсутствует |
Норма, отсутствие диагностической значимости (так же проистекают скрытые формы заболеваний плевры) |
Желчного цвета |
Холеторакс (билиарная фистула) |
|||
Желто-зеленый |
Туманная (четкая после центрифугирования) |
Вязкая, густая |
Стафилококковая эмпиема |
|
Коричневый (цвета «анчоуса») |
Водянистая |
Распадающийся амебный абсцесс |
||
Розовый, вплоть до красного |
Нет |
Гемоторакс (травма, опухоль, ятрогения) |
||
Молочно-белый |
Туманная (четкая после центрифугирования) |
Хилоторакс/псевдохилоторакс |
||
Темный, черный |
Частично водянистая |
Аспергиллезная инфекция |
||
Нет |
Водянистая |
Хилоторакс (билиторакс, в основном ятрогенный) |
||
Желто-зеленый |
Туманная (четкая после центрифугирования) |
От водянистой до вязко-тягучей |
Зловонный или гнойный, «гнилостный запах» |
Эмпиема анаэробной этиологии |
Коричнево-зеленый |
Сладковатый |
Эмпиема (синегнойная палочка) |
||
Коричневый |
Вязкая |
Фекальный |
Эмпиема (кишечная палочка) |
|
Желтый, вплоть до желто-зеленого |
Нечетко-водянистая |
Отсутствует |
Туберкулезный плеврит |
|
Прозрачный, вплоть до желтого |
Нечеткая (четкая после центрифугирования) |
Частицы пищи |
Повреждение пищевода |
|
Желтый, вплоть до розового, или красный |
Нет |
Жесткая тягучая |
Мезотелиома |
|
Цитология выпота положительная на опухолевые клетки при первом исследовании у 60% больных со злокачественными опухолями. Если представлены три различных (или отдельных) материала, выявление опухолевых клеток достигает 90%. Результат зависит от вида опухоли, например при лимфогранулематозе положителен лишь у 25% больных, при аденокарциноме — у большинства больных.
Исследование клеточного состава плеврального выпота и биохимическое исследование способствуют установлению наиболее вероятной причины выпота, дифференциации транссудата и экссудата.
Если в плевральной жидкости гематокрит более 50%, то надо думать о гемотораксе, если меньше 1% — то крови в ней нет, а если от 1 до 50%, то возможен злокачественный опухолевый процесс, ТЭЛА, травма [52].
Количество лейкоцитов >10 000/мл бывает при эмпиемах плевры, парапневмоническом плеврите, панкреатите, ТЭЛА, сосудистых коллагенозах, злокачественных процессах и туберкулезе [52].
Большее значение имеет соотношение клеток в плевральной жидкости (макрофаги — 75%, лимфоциты — 23%) [53, 68]. Содержание в плевральном выпоте преимущественно полиморфноядерных лейкоцитов требует сосредоточения внимания на дифференциальной диагностике пневмоний, ТЭЛА, панкреатита, внутрибрюшного абсцесса, туберкулеза. При хронических процессах в выпоте больше мононуклеарных клеток [53].
Эозинофильный плевральный выпот отмечен при злокачественных и парапневмоническом процессах, туберкулезе, ТЭЛА, транссудате и др. [54].
Лимфоцитарные плевральные выпоты свойственны туберкулезу и злокачественным ново образованиям [52, 55]. При этом лимфоцитов более 50%, преобладают Т-клетки (CD4+) [56].
При хронических лимфолейкозах лимфоциты, как правило, представлены В-клетками [57].
Злокачественные клетки при выпотах, обусловленных злокачественными процессами, выявляются с частотой от 40 до 87% [52, 58, 59]. При болезни Ходжкина положительные результаты цитологии обнаруживаются в 25% случаев [60], а при аденокарциноме очень часто [59, 61]. Выше диагностическая ценность при торакоскопии [59, 61, 62]. Дополняет данные цитологии определение рецептора эпидермального фактора роста (EGFR) [63, 64].
Среди других диагностических тестов на злокачественную опухоль следует отметить [5]: флюоресцентную in situ гибридизацию с хромосом-специфическими пробами; определение потери гетерозиготности; сравнительную геномную гибридизацию; определение опухолевых маркеров; иммуногистохимические и другие исследования для диагностики злокачественной опухоли. Наиболее часто для дифференцировки аденокарциномы от мезотелиомы применяют следующие маркеры: эпителиальные маркеры — B72/3, Ber-EP4, Leu-M1; мезотелиомные маркеры — кальретинин, мезотелин, цитокератин 5/6.
Биохимические исследования. Выпот исследуют на ЛДГ и белок и при подозрении на экссудат — на амилазу, сахар, микрофлору и т.д. Плевральный выпот может быть разделен на экссудат и транссудат в зависимости от концентрации белка, ЛДГ и клеточных компонентов (табл. 12.4).
| Показатели | Значения | Наиболее вероятные причины |
|---|---|---|
Соотношение гематокрита в выпоте к крови |
>50% |
Гемоторакс |
>1%, но <50% |
Злокачественная опухоль, ТЭЛА, травма |
|
Эритроциты |
>100 000/мм3 |
Злокачественная опухоль, травма, ТЭЛА |
Лейкоциты |
>10 000/мм3 |
Эмпиема, парапневмонический экссудат, панкреатит, ТЭЛА, коллагеноз, редко — злокачественная опухоль, туберкулез |
<1000/мм3 |
Транссудат |
|
Нейтрофилы |
>50% |
Острый плеврит |
Лимфоциты |
>90% |
Туберкулез, злокачественная опухоль |
Эозинофилы |
>10% |
Асбестоз, пневмоторакс, разрешающаяся инфекция |
Мезотелиальные клетки |
Отсутствуют |
Туберкулез |
Имеют признаки злокачественности |
Мезотелиома |
|
Соотношение концентрации в выпоте к концентрации в плазме |
||
Белок |
>0,5 |
Критерий экссудата |
ЛДГ |
>0,6 |
Критерий экссудата |
ЛДГ в выпоте |
>200 МЕ |
Критерий экссудата |
ЛДГ в выпоте к верхней границе нормы в крови |
>2/3 |
Критерий экссудата |
Глюкоза в выпоте |
< 3,33 ммоль/л |
Парапневмонический экссудат, туберкулез, ревматоидный артрит, гемоторакс, парагонимиаз, cиндром Чарджа–Стросс |
>4,44 ммоль/л |
Системная красная волчанка |
|
Белок в выпоте |
>50 г/л |
Туберкулез |
<5 г/л |
Уриноторакс, перитонеальный диализ |
|
рН в выпоте |
<7,20 |
Осложенный парапневмонический выпот (эмпиема), повреждение пищевода, туберкулез, злокачественное новообразование, ревматоидный артрит, гемоторакс, системный ацидоз, парагонимиаз, системная красная волчанка, уриноторакс |
Амилаза в выпоте по отношению к концентрации в плазме |
>1 |
Панкреатит |
Более верхней границы нормы концентрации в плазме |
Повреждение пищевода, болезни поджелудочной железы, злокачественные опухоли |
|
Общепринятыми считаются критерии Лайта: 1) отношение белка в выпоте к белку в плазме более 0,5; 2) отношение ЛДГ в выпоте к ЛДГ в плазме более 0,6; 3) ЛДГ в выпоте более чем 2/3 верхней границы нормы ЛДГ в крови. При использовании классических критериев Лайта транссудат может быть ошибочно принят за экссудат, как максимум, у 25% больных.
У больных с клиническими признаками транссудата, но показателями жидкости, относящими ее к экссудату, показано определение разницы между белком сыворотки и плевральной жидкости. Если эта разница превышает 31 г/л, у больного наиболее вероятен транссудативный характер выпота [56].
При уровне белка в плевральном выпоте >5 г/л следует думать о возможности туберкулеза, а если его уровень ниже 0,5 г/л — вероятен уриноторакс.
Снижение в плевральном выпоте уровня глюкозы <60 мг/л (3,3 ммоль/л) может свидетельствовать о следующих процессах: парапневмоническом, злокачественном, ревматоидном выпоте, туберкулезном плеврите, гемотораксе, парагонимиазе, эозинофильном гранулематозе [65]. При уровне глюкозы в выпоте ниже 40 мг/л следует рассмотреть вопрос о дренировании плевральной полости. При ревматоидном плевральном выпоте уровень глюкозы может быть ниже 30 мг/л (1,7 ммоль/л) [66], при системной красной волчанке (СКВ) — >80 мг/л (4,4 ммоль/л) [67]. У больных с выпотом злокачественного генеза с низким уровнем глюкозы, выявлением в нем злокачественных клеток прогноз неблагоприятен со средним сроком выживания менее 2 мес [68, 69].
Бактериологические исследования. Культуральные исследования на аэробные и анаэробные бактерии, МБ, грибки [70]. Окраска по Граму. Бактериоскопия. Определение бактериальных антигенов путем иммуноэлектрофореза, латекс-агглютинации или бактериальной ДНК с помощью ПЦР [71–74].
Другие диагностические тесты плевральной жидкости. Определенное значение в дифференциальной диагностике плеврального выпота придается значению рН в нем (табл. 12.5)
| Значение рН | Клиническое значение | Возможные заболевания | Терапевтический вывод (действия) |
|---|---|---|---|
>7,5 |
Нормальное значение |
Отсутствуют |
Отсутствует |
7,5–7,4 |
Недифференцированное заключение |
Контроль за сохраняющимся выпотом |
|
7,4–7,3 |
Возможное патологическое заключение |
Рак плевры? |
Повторная пункция. |
7,3–7,1 |
Патологическое заключение |
Вероятна бактериальная инфекция плевральной полости (эмпиема) |
Постановка плеврального дренажа. |
<7,1 |
Верифицированная инфекция плевральной полости (эмпиема) |
Постановка плеврального дренажа. |
|
Регулярное определение рН рекомендуется при парапневмоническом выпоте. Низкий рН выпота согласуется с низким уровнем глюкозы [75].
Повышение амилазы в плевральной жидкости отмечено при перфорации или разрыве пищевода, панкреатите [76, 77].
Тесты для коллагенозов: антиядерные антитела для СКВ [78]; ревматоидный фактор для ревматического артрита. Аденозиндезаминаза [79, 80] повышена при туберкулезе [119]. Может быть повышена при эмпиеме, лимфомах, лейкозе, парапневмоническом выпоте. Интерферон-гамма — повышен при туберкулезе.
Молекулярная техника для диагностики туберкулеза: ПЦР.
Визуализация плеврального выпота:
-
многоосевая рентгенография грудной клетки (сглаженность синусов, нечеткость контуров купола диафрагмы, ограниченные параплевральные затемнения);
-
УЗИ — обнаружение жидкости, ее расположение, пункция под контролем УЗИ;
-
КТ — уточнение локализации ограниченных скоплений жидкости; диагностика причин плеврита; дифференцировка инфильтрата и жидкости.
Инвазивное исследование:
Рентгенологическое исследование. Показано при подозрении на наличие выпота в плевральной полости. При рентгенологическом исследовании в вертикальном положении жидкость накапливается в первую очередь между диафрагмальной поверхностью и нижней долей легкого. Если объем жидкости будет меньше 75 мл, она не будет видна даже в реберно-диафрагмальном углу. Присутствие большого количества жидкости приводит к перетоку выпота в реберно-диафрагмальный синус. При этом стирается граница между диафрагмой и легким. Затемнение реберно-диафрагмального узла свидетельствует чаще всего о наличии в плевральной полости 175 мл жидкости [81]. Однако иногда даже 500 мл плевральной жидкости не приводит к затемнению реберно-диафрагмального синуса. Ошибочная диагностика наличия плевральной жидкости может произойти, если реберно-диафрагмальный синус затемнен вследствие пневмонии в нижней доле [82].
Присутствие клинически значимого количества жидкости в плевральной полости может быть исключено, если оба задних реберно-диафрагмальных угла свободны. При подозрении на жидкость необходима рентгенограмма лежа на боку или УЗИ, так как правильное расположение больного на боковой рентгенограмме в положении лежа на боку позволяет выявить минимальное количество жидкости в плевральной полости в объеме 5 мл [5, 33]. При отграниченном плевральном выпоте показаны УЗИ и КТ.
Рентгенограмма в положении лежа на боку может быть востребована для решения вопроса о торакоцентезе. Если слой жидкости между наружной стенкой легкого и внутренним контуром грудной полости меньше 10 мм, то торакоцентез проводить не следует [83].
Жидкость может инкапсулироваться между париетальной и висцеральной плеврой, что нередко наблюдается при парапневмонических и туберкулезных плевритах.
УЗИ. Метод прост и быстро исполним, не связан с ионизирующим излучением, повторяем через любые периоды времени [84]. УЗИ позволяет выбрать место для торакоцентеза [49], снижает риск пневмоторакса [85].
Компьютерная томограмма. Оптимальный способ визуализации плеврального выпота, определения его локализации, распространения, отделения легочной патологии от плевральной [84, 86]. Транссудат от экссудата по показателям плотности не различить [87]. КТ показано при дифференциальной диагностике абсцесса легкого и эмпиемы [88], полезно при дифференциации злокачественных и доброкачественных причин плеврального выпота [84, 89], в сочетании с ангиографией помогает решить вопрос о ТЭЛА [90].
МРТ. Позволяет выявить жидкость в плевральной полости [84]. Применяется для дифференциации злокачественных и доброкачественных процессов, диафрагмальных грыж. В целом ее значение в этой области меньше, чем КТ и УЗИ.
ПЭТ. При выполнении с меченной радиоизотопом F-18 фтордеоксиглюкозой помогает дифференцировать злокачественные поражения от доброкачественных, стадировать злокачественные опухоли и диагностировать рецидивы [84, 91].
Инвазивные исследования у больных с неустановленным диагнозом при наличии экссудативного плеврального выпота
Их несколько: пункционная биопсия плевры с помощью иглы, бронхоскопия, торакоскопия, открытая биопсия плевры.
У 20% больных с экссудативным плевральным выпотом диагностировать причину не удается, и у многих выпот исчезает спонтанно и бесследно [5, 92, 93].
Есть три причины, побуждающие к инвазивным исследованиям:
Пункционная биопсия плевры с помощью иглы. Чаше используют иглы Cope и Abrams. Применима в основном при туберкулезе и злокачественных опухолях. При злокачественных опухолях положительный результат от 40 до 60% [93, 94, 96]. Цитология может дать результат выше, чем гистология, — 58–69 против 43–78% [93]. При туберкулезе пункционная биопсия более информативна. Положительна в 50–80% [97]. Кроме того, можно получить МБ в 92–95% случаев [98, 99] и оценить их чувствительность к препаратам.
При подозрении на злокачественную опухоль показана торакоскопия с биопсией.
Бронхоскопия. При наличии у больного с выпотом также паренхиматозного поражения или кровохарканья бронхоскопия помогает в постановке диагноза у 75% больных, если паренхиматозного поражения или кровохарканья нет — у 10% и менее. Поэтому при наличии кровохарканья необходима бронхоскопия после КТ для выявления паренхиматозной патологии [5, 100, 101].
Плевроскопия, торакоскопия или видеоассистированная торакоскопическая хирургия. Проводится в основном при неясности диагноза после пункционной биопсии. Хотя у многих больных, особенно со злокачественными опухолями, плевроскопию можно применить вместо пункционной биопсии в связи с большей диагностической ценностью и возможностью плевродеза [102].
Открытая биопсия плевры. Основное показание — недиагностированное прогрессирующее заболевание плевры при отсутствии результата после торакоскопии или невозможности биопсии с помощью торакоскопии [42, 103, 104].
Транссудативный плевральный выпот
Часто сопутствует многим заболеваниям. В большинстве случаев первично поражена не плевра или легкие, а другие органы, в первую очередь сердце, печень и почки.
Хроническая сердечная недостаточность
Наиболее частая причина транссудативного плеврального выпота [65]. 83% больных с обострением хронической сердечной недостаточности имели плевральный выпот справа, а 77% — слева [105]. У трети этих больных объем выпота превысил 700,0 мл.
Патофизиология
Выход легочной интерстициальной жидкости в плевральную полость через проницаемый мезотелий подтверждается большой частотой выпота у больных с рентгенологически установленным отеком легкого, а также большей корреляцией наличия выпота с легочным венозным давлением, чем с системным венозным или легочным артериальным давлением [12, 13, 106]. При отеке легких велика вероятность формирования плеврита [107].
Клиническая симптоматика
Основные симптомы хронической сердечной недостаточности: одышка, диспноэ при нагрузке, ортопноэ, никтурия, периферические отеки, растяжение вен шеи, влажные хрипы и расщепление сердечного тона (сердечный галоп) в сочетании с кардиомегалией на рентгенографии грудной клетки. Симптомы дыхательной недостаточности будут превалировать при большом количестве выпота и выраженном отеке легких [3].
В посмертном исследовании, как правило, выявляют двусторонний (88%) плевральный выпот с большим количеством жидкости справа (1084 мл), слева — 913 мл [108].
Диагностика и лечение
Обычно подозрение возникает уже по клинической картине. Торакоцентез показан, если выпот односторонний или с одной стороны несравнимо больший; если пациент фебрильно температурит; если у больного боль в грудной клетке; если у больного нет кардиомегалии [65]. Плевральная жидкость при хронической сердечной недостаточности чаще транссудат [47]. При отсутствии данных критериев у пациента необходимо лечить хроническую сердечную недостаточность. Диагностический торакоцентез показан только в случае отсутствия эффекта со стороны выпота.
При приеме диуретиков биохимические свойства выпота могут измениться так, что он может походить на экссудат (ЛДГ и белок) [109].
Необходимо лечить с помощью снижающих нагрузку на сердце препаратов, диуретиков и инотропов по показаниям. Обычно при улучшении со стороны сердца выпот исчезает. При значительном диспноэ для его купирования требуется лечебный торакоцентез.
Изредка, несмотря на лечение, у больного накапливается жидкость в большом объеме. При наличии диспноэ и его хорошем купировании торакоцентезом у таких больных возможно применение плевродеза доксициклином или тальком [5].
Заболевания перикарда
Несмотря на высокую частоту возникновения плеврального выпота при заболеваниях перикарда, механизм его возникновения до конца не ясен. При констриктивном перикардите объяснением может быть повышение легочного и системного капиллярного давления. При воспалительном заболевании перикарда выпот в основном левосторонний, и возможная его причина — переход воспаления с перикарда на прилежащую плевру. Лечение должно быть направлено в первую очередь на основное заболевание.
Гидроторакс при циррозе печени
У 5–6% больных с циррозом печени развивается плевральный выпот [48, 110, 111]. Такая вероятность больше при асците, хотя у некоторых больных с выпотом асцита может не быть.
Патофизиология
Основной механизм — движение асцитической жидкости из брюшной полости через поры, ходы Люшки в диафрагме в плевральную полость [21]. Поры в диафрагме были продемонстрированы в ряде исследований [110, 112]. Второй фактор — снижение онкотического давления плазмы. Третий фактор — градиент давления между брюшной и грудной полостями [110, 113, 114].
Клиническая симптоматика
Обычно доминируют симптомы цирроза и асцита. Если много жидкости в плевральной полости, то возникает диспноэ. Обычно выпот справа (у 2/3 больных), но у 1/6 — слева и у 1/6 — двусторонний [48]. При большом количестве выпота может возникнуть одышка [115].
Диагностика и лечение
Ведущими методами являются рентгенологические исследования плевральной полости, диагностика основного заболевания. Если имеются сомнения — то сканирование грудной клетки после введения в брюшную полость Тс99м меченного коллоида [116]. Для доказательства, что обе жидкости — транссудат, необходимы лапароцентез и торакоцентез [117]. Уровень белка в плевральном выпоте выше, чем в асцитическом [117], но ниже 3 г/л [117].
Первичное лечение цирроза с асцитом и плевральным выпотом должно быть направлено на лечение асцита [3]. Показаны низкосолевая диета и диуретики. Декомпрессия портального кровообращения с помощью оперативного трансъюгулярного внутрипеченочного портосистемного шунтирования может быть показана для лечения основного заболевания. Если не помогают, тогда метод выбора — трансплантация печени [114, 174]. Дренирования плевральной полости нужно избегать в связи с большими потерями жидкости и белка из-за перетока асцитической жидкости в плевральную полость и вытекания ее по дренажу наружу [114]. Если имплантация шунта и трансплантация печени неосуществимы, то лучшей альтернативой может быть видеоторакоскопическая операция с закрытием диафрагмальных дефектов и плевродезом. У ряда больных возможно еще проведение перитонеально-венозного шунтирования, хотя его результаты часто остаются неудовлетворительными [48]. Продолжается изучение вопроса о закрытии функциональных дефектов диафрагмы и плевродезе [119–121].
Нефротический синдром
Плевральный выпот часто выявляется у больных с нефротическим синдромом [122]. Механизм возникновения: снижение онкотического давления плазмы и повышение гидростатического давления (на фоне солевой задержки и гиперволемии) [3]. Обычно выпот двусторонний [122]. Диагностический торакоцентез должен быть выполнен у всех больных с нефротическим синдромом и плевральным выпотом, чтобы доказать, что жидкость — транссудат [3]. Тем не менее всегда необходимо исключить ТЭЛА у больных с нефротическим синдромом и плевральным выпотом (в связи с высоким риском венозных тромбозов у данной категории больных) [44], и если плевральный выпот имеет признаки экссудата, то показаны сцинтиграфия легких и спиральная КТ.
Лечение направлено на повышение белка в плазме путем снижения его почечных потерь. Если это неэффективно, то для больных с выраженной симптоматикой из-за плеврального выпота следует рассмотреть вопрос о проведении плевродеза.
Перитонеальный диализ
Иногда осложняется гидротораксом [3]. Это результат движения диализата из брюшной полости в плевральную [123]. В 90% случаев выпот правосторонний [123, 124]. Уровень глюкозы в плевральном выпоте ниже, чем в асцитической, белок менее 10 г/л, низкая ЛДГ [3]. Хотя сообщение между брюшной и плевральной полостями у некоторых больных закрывается спонтанно, при необходимости продолжения перитонеального диализа показано хирургическое лечение. Методом выбора является торакоскопия с закрытием дефектов в диафрагме и плевродезом [3]. Альтернативой может быть просто плевродез или торакотомия с ушиванием диафрагмальных дефектов [125, 126].
Обструкция мочевыводящих путей (уриноторакс)
Обструкция мочевыводящих путей, приводящая к забрюшинному накоплению мочи (уринома), может привести к плевральному выпоту [127]. Механизм неясен, но, вероятно, жидкость поступает вдоль градиента давления в плевральную полость. Выпот представляет собой мочу и пахнет как моча. Диагноз ставится на основании одновременного измерения уровня креатинина в крови и выпоте. Только больные с обструкцией мочевыводящих путей могут в 90% случаев иметь креатинин в выпоте выше, чем в крови [127]. Когда обструкция мочевыводящих путей купирована, выпот быстро исчезает [128].
Микседема
Большинство больных микседемой и плевральным выпотом имеют сопутствующий перикардиальный выпот — транссудат [129]. Если плевральный выпот изолированный, то он пограничный между экссудатом и транссудатом [129]. Механизм формирования выпота неизвестен. Возможно, играет роль снижение функциональной активности лимфатической системы из-за низкого уровня тиреоидных гормонов [130]. Лечение направлено на основное заболевание — заместительная терапия тиреоидными гормонами.
Констриктивный перикардит
Частота плеврита при конструктивном перикардите варьирует от 28 до 60% [131, 132]. Он носит характер транссудата, обусловленного градиентом давления в системном и легочном капиллярном кровотоке по отношению к перикарду, возможно движение жидкости от перикарда в плевральную полость [3].
Другие причины транссудата
Субарахноидально-плевральные свищи развиваются вследствие накопления спинномозговой жидкости в плевральной полости через фистулы, проникающих ранений, переломов [65]. Этот транссудат характеризуется низким давлением ЛДГ и белка. В нем определяется β-2 трансферрин [133].
Центральные венозные обструкции, в том числе v. hemiazygos, брахиоцифальных вен, верхней полой вены, формируют в плевральной полости накопления транссудата [134]. Накопление транссудата в плевральной полости наблюдается также при легочно-венозной окклюзии [135].
При правожелудочковой недостаточности с вторичной ЛГ бывает небольшой двусторонний плевральный выпот [136]. Эти выпоты носят характер транссудата. В то же время есть данные, что при ТЭЛА наблюдается и экссудативный характер выпота [137].
При амилоидозе отмечается развитие плеврального выпота в виде транссудата [138], что связывают с подавлением образования фактора роста эндотелия сосудов [139].
Экссудативный плевральный выпот
Может развиваться вследствие воспаления, травм, злокачественных новообразований и др.
Тромбоэмболия легочной артерии
Частота образования плеврального выпота при ТЭЛА составляет 30% [140]. Клинически выделяют следующие категории:
При первом варианте клинического течения плевральный выпот определяется у 56% больных, при втором — у 26%, при третьем — не наблюдается [140]. На рентгенограмме определяется помутнение легочной ткани, чаще всего в нижних долях, с выпуклостью в воротах легких [141]. Можно определить притупление в реберно-диафрагмальном углу. Выпот обычно занимает меньше 1/3 гемиторакса [140], может быть одно- или двусторонним [142].
Анализ плеврального выпота большого значения для диагностики не имеет. Плевральный экссудат характеризуется количеством эритроцитов более 100 000/мкл у 30% больных [137]. Количество лейкоцитов варьирует от менее 100 до более чем 50 000/мкл. Превалируют полиморфноядерные лейкоциты.
Лечение больных с плевральным выпотом у больных с ТЭЛА соответствует методике лечения основного процесса. Геморрагический выпот не является противопоказанием к гепаринотерапии и, если показано, к тромболитической терапии.
Ревматоидный артрит
Ревматоидный артрит наблюдается у 5% больных ревматоидным артритом [79, 143]. У мужчин, страдающих ревматоидным артритом, плеврит возникает чаще (>10%), чем у женщин (<2%) [79, 143].
Ревматоидный плеврит выявляется у лиц старше 35 лет после нескольких лет страдания ревматоидным артритом [79]. Может протекать бессимптомно или сопровождаться болью в груди, лихорадкой, одышкой [79, 144]. Количество жидкости в плевральных полостях на рентгенограммах небольшое. У 25% больных выпот билатерален [79]. Поражения плевральных полостей могут чередоваться.
Плевральная жидкость при ревматоидном полиартрите имеет уровень глюкозы до 30 мг/л, ЛДГ >2 раз от верхнего предела нормального уровня, рН <7,20, высокий ревматоидный фактор (в титре >1:320 и ≥титра сыворотки) [144]. Иногда уровень глюкозы в жидкости не низкий. Ревматоидный плевральный выпот содержит кристаллы холестерина или высокий уровень холестерола [145]. Цитологически выявляются специфические удлиненные макрофаги [146].
В плане прогноза выпот может быть стойким, давать утолщение плевры, а может спонтанно разрешаться в течение 3 мес [3].
При лечении нет подтверждения неэффективности противовоспалительной терапии. Получены определенные результаты после внутриплевральных введений глюкокортикоидов. При одышке и утолщении плевры показана декортикация.
Плеврит при системной красной волчанке
Плеврит при СКВ встречается у 40% пациентов [80]. В клинической картине — боли в груди, лихорадка, обострение основного процесса. У 50% больных выпот двусторонний [147]. Симптомы, связанные с медикаментозной волчанкой, прекращаются в течение нескольких дней. Плевральная жидкость содержит либо полиморфноядерные, либо одноядерные клетки [67]. Повышение волчаночного титра неспецифично и нечувствительно для диагностики волчаночного плеврита [78, 148]. Диагноз основывается на клинической картине и серологических результатах исследования волчанки.
Начинать лечение рекомендуется с преднизолона. Если обострение вызвано каким-либо препаратом, то он должен быть отменен.
Другие воспалительные заболевания
Плевральный выпот может быть при эозинофильном гранулематозе с полиангиитом (синдром Чарджа–Стросс), гранулематозе Вегенера, синдроме Шегрена.
Саркоидоз
Частота плеврального выпота при саркоидозе составляет 1% [149, 150]. Обычно это наблюдается при легочно-паренхиматозном и экстраторакальном саркоидозе [149].
Плевральный выпот может формироваться бессимптомно, проявляться болью в груди, одышкой. Жидкости небольшое количество, у 1/3 она обнаруживается билатерально. В жидкости определяются малые лимфоциты [149, 150], саркоидные клетки.
Плеврит при саркоидозе может разрешиться самостоятельно или при лечении глюкокортикоидами [3].
Воздействие асбеста
Развитие плеврального выпота может наблюдаться спустя годы после воздействия асбеста [151], от 5 лет с момента первоначального воздействия [152].
Волокна асбеста из легких проникают в плевральную полость, осаждаются на париетальной плевре, вызывают субфебрилитет, увеличивает проницаемость капилляров и уменьшает ее лимфодренаж [3].
У 66% больных течение болезни бессимптомно [151]. На рентгенограмме выявляется плевральный выпот в малом объеме, в 10% случаев билатерально. В 52% случаев в жидкости наблюдаются эозинофилы [153].
Диагноз доброкачественности процесса ставится с исключением ТЭЛА, злокачественных новообразований [152]. Для исключения мезотелиомы применяются торакоскопия, биопсия. Плевральный выпот сохраняется в течение 3 мес [3]. Массивный плевральный фиброз развивается у 20% больных [151], коллабирование легкого — у 10%.
Уремия
Плевральный выпот при уремии развивается в 3% случаев [65]. Он носит характер фиброзного плеврита. При применении гемодиализа плевральный выпот на КТ определяется в 24–50% случаев [16, 154–156]. Объем выпота часто занимает более 50% половины грудной клетки, а у 20% больных он двусторонний [157].
В клинической картине отмечаются лихорадка, боль в груди, кашель, одышка. Плевральная жидкость может стать серозно-геморрагической, в ней преимущественно выявляются лимфоциты [157].
При применении гемодиализа в течение 4–6 нед выпот исчезает у 75% больных. Если плевра утолщена, иногда требуется декортикация.
Синдром после травмы сердца, инфаркта миокарда (Дресслер)
Характеризуется триадой: перикардит, плеврит, пневмония [158, 159].
В клинической картине могут быть раздражительность, шум трения перикарда. Ряд авторов [156] определили эти синдромы как наличие более двух симптомов из следующего перечня: лихорадка, боль в груди, шум трения перикарда, новые зоны или прогрессирование имевшегося плеврита либо перикардита. Заболеваемость синдромом после травмы сердца или при инфаркте миокарда составляет 1%, после остановки сердца — несколько выше [65]. Синдром развивается обычно через 3 нед после травмы, но может в период от 3 дней до 1 года.
На рентгенограмме у 50% пациентов выявляется усиление легочного рисунка. Плеврит возникает у 2/3 больных [158], жидкость носит серозно-геморрагический характер.
Лечение — противовоспалительное, в тяжелых случаях глюкокортикоиды, пункция перикарда, торакоцентез [13].
После аортокоронарного шунтирования
Плевральный выпот образуется в 10% случаев и занимает болеее 25% гемиторакса [161], чаще слева.
Частота небольших объемов плеврального выпота варьирует от 11 до 89% [162] в течение 30 дней после операции.
Основной симптом — диспноэ [161], боль в груди, лихорадка.
Жидкость может быть серозно-геморрагическая или серозная. Серозно-геморрагический выпот связан, вероятно, с вторичным кровотечением. Его отличает высокий уровень ЛДГ [163]. Лечится с помощью торакоцентеза [163]. Серозный выпот максимально накапливается в сроки более 30 дней после операции, содержит более 50% лимфоцитов и имеет низкий уровень ЛДГ [163]. Он также лечится с применением торакоцентеза [161]. Эффективность противовоспалительных средств или диуретиков не доказана. Установлена эффективность колхицина в отношении объема жидкости в плевральной полости и в полости перикарда [164].
Возникновение плеврального выпота может быть связано с применением ряда ЛС:
Трансплантация легких
При трансплантации легких разрываются лимфатические пути, возникают послеоперационные осложнения (гемоторакс, плеврит и т.д.), что увеличивает летальность [165].
Плевральный выпот развивается через 3 мес после операции с частотой 30–60% [166, 167], через 12 мес — 10% [167]. В экссудате превалируют лимфоциты [166]. Развитие плеврального выпота увеличивает риск эпизодов острого и хронического отторжения, инфекционного процесса.
Синдром Мейгса
Синдром Мейгса характеризуется асцитом, плевритом в ассоциации с доброкачественной опухолью яичников, матки (фибромиомы). Продуцируется большое количество жидкости. Важную роль играет эпидермоидный фактор роста [168].
При этом синдроме имеют место хронические заболевания, потеря массы тела, плеврит, асцит, опухолевая ткань в малом тазу. В жидкости мало лейкоцитов, иногда много эритроцитов, повышен СА-125 [168].
Заключение
Плевральный выпот — часто встречающаяся патология, в генезе которой, кроме патологии легких, имеют значение многие экзо- и эндогенные факторы, обусловленные особенностями морфологии, физиологии и патологии плевры, плевральной полости, а также большим количеством болезней системного и органного характера, инфекционными факторами и др. Новые представления о структуре и функции плевры позволяют по-новому взглянуть на проблему формирования плеврального выпота и определить дифференцированный подход к диагностике и лечению этой комплексной проблемы.