Функциональная диагностика : национальное руководство / под ред. Н. Ф. Берестень, В. А. Сандрикова, С. И. Федоровой - Москва : ГЭОТАР-Медиа, 2019. - 784 с. (Серия "Национальные руководства") - ISBN 978-5-9704-4242-5 |
Аннотация
Национальное руководство по функциональной диагностике выходит в нашей стране впервые. В нем представлены все современные исследования, проводимые в отделениях и кабинетах функциональной диагностики. Рассмотрен алгоритм проведения и описания исследований, анализа и интерпретации результатов использования аппаратных методов по трем основным направлениям диагностики социально значимых заболеваний: сердечно-сосудистой системы; центральной, периферической и вегетативной нервной системы; функции внешнего дыхания.С помощью методов функциональной диагностики исследуется состояние и других систем организма человека (пищеварительной, эндокринной, органов кроветворения). Особое значение приобретают и полифункциональные исследования. Описаны понятия нормы у здоровых лиц и патологии у больных, а также результат исследований в виде функционального диагноза. Изложены особенности функциональных исследований у детей, физически активных лиц и спортсменов.
Книга содержит перечень всех методов функциональной диагностики, а также проект примерных рекомендуемых нормативов затрат рабочего времени для отдельных групп исследований кабинетов/отделений функциональной диагностики Российской ассоциации специалистов функциональной диагностики.
В подготовке данного руководства приняли участие ведущие специалисты России по функциональной диагностике и в смежных областях.
Издание предназначено врачам функциональной диагностики и всех клинических специальностей, использующим в работе различные методы функциональной диагностики и их результаты, медицинским сестрам, студентам медицинских вузов, ординаторам и аспирантам.
11.11. НЕЙРОСОНОГРАФИЯ
Н.А. Шнайдер
Обоснование метода
Нейросонография (НСГ) - методика УЗИ головного мозга ребенка раннего возраста (новорожденного и младенца) до момента закрытия большого родничка.
НСГ представляет собой основной диагностический метод оценки зрелости мозга у новорожденных, особенно у недоношенных. Вследствие высокой заболеваемости у гестационно незрелых новорожденных скрининговая НСГ требуется каждому младенцу. Динамическое проведение НСГ таким детям в целях своевременной диагностики тяжелой постгеморрагической гидроцефалии имеет большое клиническое значение. Недоношенные новорожденные также подвержены риску церебральной ишемии, в частности, при перивентрикулярной лейкомаляции, которая достаточно точно диагностируется сонографически и (в тяжелых случаях) предполагает плохой прогноз почти у всех младенцев, страдающих таким заболеванием. НСГ также служит отличным методом для оценки отклонений, не связанных с гестационной незрелостью. НСГ помогает в диагностике врожденных пороков развития головного мозга, используется при оценке состояния детей с воспалительными процессами.
МЕТОДИКА НЕЙРОСОНОГРАФИИ
Показания к немедленной (нескрининговой) НСГ
Показания к скрининговой НСГ в период новорожденности (в родильном доме)
Показания к НСГ в возрасте 1 мес и старше
Как правило, НСГ назначает педиатр родильного дома (неонатолог) и/или детский невролог поликлиники в 1-й месяц жизни ребенка в рамках скрининга. В дальнейшем НСГ проводят на 3-й, 6-й месяц и до закрытия большого родничка. Основными показаниями к НСГ служат подтверждение или исключение внутричерепного кровоизлияния у недоношенных новорожденных, наблюдение за эволюцией внутрижелудочкового кровоизлияния и осложнений ишемии головного мозга, диагностика врожденных пороков развития головного мозга, структурных внутричерепных сосудистых поражений.
Абсолютных противопоказаний к НСГ нет.
Относительные противопоказания к НСГ: заболевания кожи головы или негативная психологическая реакция ребенка на проводимое исследование.
Подготовка пациента к НСГ существенно не отличается от таковой к ЭхоЭГ, описанной выше; предварительной, а также специальной, в том числе медикаментозной, подготовки к НСГ не требуется.
Ребенок не должен быть голоден, испытывать жажды. Исследование может быть проведено как в состоянии бодрствования, так и во сне. Если ребенок заснул, будить его не нужно: сон позволит обеспечить неподвижность головы во время исследования. Перед НСГ не следует накладывать кремы или мази на область родничка, даже если к этому есть показания. Это ухудшает контакт датчика с кожей, а также негативно влияет на визуализацию головного мозга.
Однако есть существенные особенности подготовки к НСГ, которые необходимо соблюдать перед процедурой у новорожденных в инкубаторе. НСГ предпочтительно осуществлять через головное отверстие инкубатора. Следует проявлять осторожность, чтобы не переместить новорожденного или не вызвать каких-либо нарушений температуры инкубатора. Давления датчика над большим родничком следует избегать, особенно в критическом состоянии у недоношенных новорожденных. Все асептические меры предосторожности необходимо соблюдать в соответствии с протоколами неонатального отделения интенсивной терапии.
По традиционной методике НСГ выполняют через большой родничок в положении ребенка лежа на спине. Наилучшие результаты НСГ могут быть получены при использовании высокочастотного датчика (5-8 МГц) с малой площадью зонда. Изображения с высоким разрешением у недоношенных новорожденных могут быть получены с использованием частоты датчика 7,5 МГц. Технические трудности могут возникнуть при получении наилучшего изображения в случае малого размера родничка, но поэтапное преобразование массива малых размеров и широкий угол озвучивания (до 140°) помогают улучшить качество диагностики.
НСГ начинается с получения полутонового изображения (шкала серого цвета) путем ультразвукового сканирования головного мозга ребенка через большой родничок в корональной и сагиттальной плоскостях. Как правило, получают и анализируют от шести до восьми корональных снимков, начиная от передних отделов лобных долей и заканчивая затылочными долями позади треугольников боковых желудочков (рис. 11.63). Затем датчик поворачивают на 90° и получают пять сагиттальных изображений, в том числе средней линии и двух парасагиттальных изображений правого и левого полушарий, включая конвекситальную кору головного мозга (рис. 11.64). Цветные изображения артериальных и венозных образований могут быть получены путем ЦДК сосудистых структур [11], при этом неотъемлемую часть НСГ составляет документация результатов визуализации виллизиева (большого) артериального круга и области венозного кровообращения вены Галена. Должны быть исследованы пиковая систолическая скорость, конечно-диастолическая скорость кровотока и индекс резистентности для оценки ишемии головного мозга. Использование мощностного допплеровского исследования также некоторыми авторами рекомендуется для поиска областей гиперили гипоинтенсивных кровеносных сосудов при подозрении на окклюзию сосудов, ишемию или инфаркт головного мозга [8]. Допплеровское исследование церебрального кровотока новорожденных в современных условиях проводят достаточно часто. Исследование кровотока в банальных ситуациях требует немного времени и может быть ограничено визуализацией сосудистого русла во фронтальных и сагиттальных проекциях и определением числовых характеристик церебрального кровотока в ПМА и вене Галена. В сагиттальной плоскости сканирования можно проследить ветви 3-4-го порядка с сохранением сосудистого рисунка на протяжении всего сердечного цикла; соответственно относительно низкому периферическому сопротивлению артериального церебрального кровотока: резистивный индекс Пурсело составляет около 0,7. Венозный кровоток носит монофазный характер.
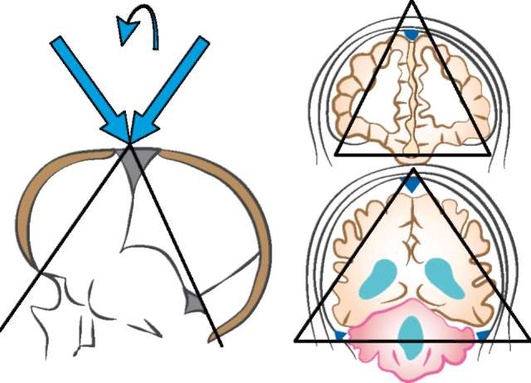
Рис. 11.63. Иллюстрация корональной нейросонограммы, демонстрирующая фронтальную (лобную) и заднюю париетальную (теменную) плоскости сканирования [5]
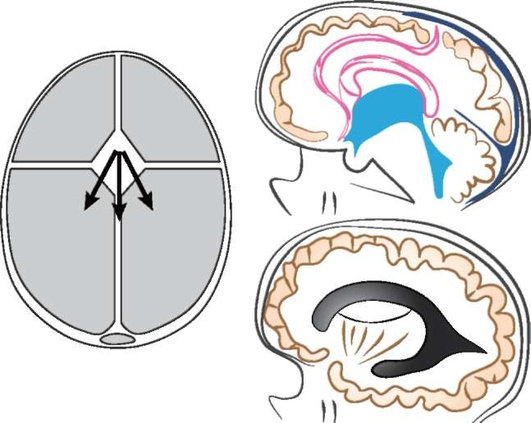
Рис. 11.64. Иллюстрация сагиттальной и парасагиттальной нейросонограммы, демонстрирующая срединную сагиттальную и вентрикулярные (желудочковые) плоскости сканирования [5]
В отдельных случаях, преимущественно при тяжелых перинатальных поражениях головного мозга, могут быть использованы нестандартные доступы через передний и задний боковые роднички, затылочный родничок, большое затылочное отверстие, чешую височной кости. При этом головку ребенка фиксируют в необходимом для сканирования положении. Проведение НСГ через дополнительные акустические окна и получение изображений с высоким разрешением через них, возможно, увеличивает ценность методики. В частности, это может быть показано для улучшения визуализации задней черепной ямки и нарушений кровообращения в поперечных венозных синусах. Мастоидальный и задний подходы полезны для диагностики внутрижелу-дочкового кровоизлияния в область затылочного рога бокового желудочка, у пациентов с подозрением на голопрозэнцефалию, а также для диагностики небольших кровоизлияний на уровне ствола головного мозга и прилежащих к нему отделов мозжечка [7].
Сканирование через чешую височной кости позволяет достоверно визуализировать контралатеральные теменные области и должно обязательно проводиться у грудных детей с травмой головы (младенцы после падения с пеленальных столиков, диванов, рук родителей, из колясок составляют значительную долю всех пациентов травматологических отделений). Если проводится осмотр реанимационного новорожденного с использованием нестандартных доступов для НСГ, изменение положения головки ребенка должно проводиться только с разрешения присутствующего при осмотре лечащего врача под контролем жизненно важных функций.
Наиболее тяжелый контингент новорожденных осматривают непосредственно в реанимационных кувезах без перекладывания ребенка на кушетку кабинета УЗИ либо при наличии переносных ультразвуковых аппаратов - на месте.
Трансляция (перенос) анатомии головного мозга на результаты НСГ нуждается в понимании физических ультразвуковых (сонографических) принципов. В целом, общие принципы УЗИ применяются к НСГ.
Во-первых, пространства, заполненные спинномозговой жидкостью, анэхогенные, в то время как сосудистое сплетение, мелкие кровоизлияния, а также участки инфаркта мозга гиперэхогенны. На НСГ серое вещество больших полушарий головного мозга имеет тенденцию быть гипоэхогенным, а белое вещество - гиперэхогенным.
Во-вторых, нормальный головной мозг всегда почти симметричен. Это позволяет обнаружить ранние изменения, характерные для инфаркта мозга или фокальной ишемии. Двусторонние симметричные изменения, вызванные системным процессом, могут привести к ошибкам в интерпретации НСГ.
В-третьих, видимые слои нормальной конвекситальной коры головного мозга следует рассматривать как гипоэхогенное вещество, которое снаружи (по поверхности) покрыто мягкой мозговой оболочкой в виде тонкого и хорошо выраженного гиперэхогенного слоя, а изнутри (от серого вещества - коры головного мозга) залегает гиперэхогенное белое вещество больших полушарий. Отсутствие четкой визуализации этих нормальных слоев служит показателем патологии (например, фокального кровоизлияния или ишемии/инфаркта мозга).
И, наконец, перивентрикулярное белое вещество, как правило, однородно по эхогенности, и она равна или меньше, чем эхогенность соседнего сосудистого сплетения. Асимметрия или гетерогенность перивентрикулярного белого вещества позволяет думать о патологии (например, о перивентрикулярной лейкомаляции).
Понимание нормальной изменчивости (вариабельности) анатомии головного мозга важно для интерпретации результатов НСГ. Так, полость (киста) прозрачной перегородки присутствует у 50-61% нормальных новорожденных. Полость прозрачной перегородки может быть очень широкой, шире, чем передний рог. Обычно она бессимптомна, но если нарушает ликвороотток, развивается гидроцефалия. Эта полость хорошо визуализируется на коронарном срезе между передними рогами. Полость Верге выявляется на более задних корональных срезах между телами и треугольниками боковых желудочков. Эти кистозные полости выявляются и на срединном срезе. Нечасто обнаруживается полость ниже Верге. Это пространство кажется отделенным, что хорошо видно как в сагиттальном, так и в угловом корональном срезе, - это cavum veliinterpositi, связанная с недоношенностью. Часто наблюдается незначительная асимметрия передних (лобных) рогов или тела боковых желудочков. Легкая асимметрия между правым и левым боковыми желудочками - норма, у большинства левый боковой желудочек шире. Высокая степень вариабельности обычна для затылочного рога - от его отсутствия с обеих или одной стороны до симметричных или асимметричных размеров при его наличии. По мере нарастания коры уменьшаются желудочки, то есть это признак зрелости мозга. Именно поэтому у недоношенных передние рога не щелевидные, а относительно широкие. Шпорная борозда часто формирует выпячивание в области медиальной стенки бокового желудочка. Это вдавление может имитировать масс-эффект или сгусток крови внутри желудочка при парасагиттальном срезе.
Кроме того, эхогенность паренхимы перивентрикулярного белого вещества весьма переменна, и относительная гиперэхогенность у недоношенных новорожденных может привести к неверной клинической интерпретации результатов НСГ и гипердиагностике перивентрикулярной лейкомаляции.
КЛИНИЧЕСКАЯ ИНТЕРПРЕТАЦИЯ
Незрелость структур головного мозга
Характерная для недоношенных новорожденных незрелость структур головного мозга при НСГ может быть дифференцирована достаточно отчетливо. Для этого состояния типичны следующие сонографические признаки: обеднение рисунка борозд и извилин, нечеткость дифференцировки структур головного мозга, часто незначительное расширение фрагментов боковых желудочков, повышение эхогенности перивентрикулярных областей, часто умеренное расширение полости прозрачной перегородки и полости Верге. Еще одну особенность головного мозга недоношенных детей (особенно <35 нед гестации) представляет выраженность герминативного матрикса, который располагается в проекции передних рогов и тел боковых желудочков, медиальнее и кпереди от хвостатых ядер. В ходе нормального перинатального периода герминативный матрикс подвергается регрессу - герминолизису, при этом он постепенно уменьшается в размерах и исчезает. Однако в подавляющем большинстве случаев у новорожденных на фоне хронической внутриутробной гипоксии, а зачастую и острой интранатальной гипоксии герминолизис протекает с образованием кист
Внутримозговое кровоизлияние
Одно из наиболее важных показаний к НСГ - диагностика внутримозгового кровоизлияния у недоношенных новорожденных. Рутинный НСГ-скрининг следует проводить всем новорожденным, родившимся в сроки до 30 нед беременности, 1 раз в возрасте от 7 до 14 дней новорожденности. У доношенных детей наиболее информативным и предпочтительным методом диагностики ВМК служит бесконтрастная КТ.
Области возможного кровотечения у недоношенных новорожденных располагаются в зонах примитивного герминативного (зародышевого) матрикса, которые более обширны вокруг перивентрикулярных областей боковых желудочков и вокруг височных рогов боковых желудочков. Степень выраженности герминативного матрикса уменьшается по мере зрелости новорожденного, ограничиваясь в области каудоталамической канавки. Герминативные матриксные кровоизлияния при НСГ визуализируются как участки повышенной эхогенности в области каудоталамической канавки. Такие ВМК были ранее разделены на четыре категории на основе степени тяжести кровоизлияния (рис. 11.65): I степень тяжести - кровоизлияние ограничивается областью каудоталамической канавки и размером, как правило, менее 1 см; II степень - кровоизлияние распространяется в соседние желудочки, но без дилатации (расширения) желудочков; III степень - кровоизлияние усиливается и приводит к минимальному увеличению размеров желудочков; IV степень - кровоизлияние приводит к значительной дилатации желудочков и развитию интрапаренхиматозного компонента кровоизлияния, часто со значительным масс-эффектом. Кровоизлияния в области задней черепной ямки встречаются редко и могут быть визуализированы при проведении НСГ при массивных объемах. Кровоизлияния III и IV степени связаны с неврологическим дефицитом или снижением обучаемости. За эволюцией ВМК наблюдают, оценивая НСГ в динамике.
Кровоизлияние I степени тяжести (так называемое субэпендимальное пластинчатое кровоизлияние) на НСГ визуализируется в виде эхогенного фокуса непосредственно перед каудоталамической канавкой или на ней. На корональных срезах может давать облитерирующий масс-эффект, образуя выпячивание в нижнелатеральном углу боковых желудочков. На парасагиттальных срезах определяется повышенная эхогенность в области таламокаудальной канавки - или кзади от головки, или с распространением кпереди. Может быть одноили двусторонним, а эхогенность может персистировать в некоторых случаях до 2 мес.
При диагностике небольших кровоизлияний II степени нужно помнить один важный факт: маленькие геморрагии обычно не приводят к значительной постгеморрагической гидроцефалии и, как правило, сопровождаются хорошим исходом. Кровоизлияния III степени приводят к формированию постгеморрагической гидроцефалии в течение длительного времени, поэтому важно проведение НСГ в динамике. Следует помнить, что у новорожденных с массивным внутрижелудочковым кровоизлиянием выраженная гидроцефалия может развиться в течение нескольких дней, бывает медикаментозно резистентной и требует оперативного вмешательства. Именно поэтому для оценки динамики и исхода кровоизлияния II и III степени тяжести повторную НСГ проводят еженедельно - гематома в желудочке может сохраняться до 6 нед и более.
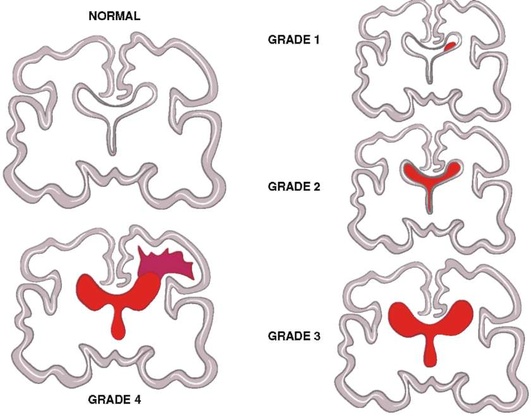
Рис. 11.65. Диаграмма степени тяжести внутримозговых кровоизлияний у новорожденных
Кровоизлияние IV степени тяжести (интрапаренхиматозное кровоизлияние) - следствие возникновения гематомы в области герминативного матрикса и распространения в ткань (паренхиму) больших полушарий головного мозга; имеет наиболее неблагоприятный прогноз. При НСГ такое кровоизлияние определяется как светящаяся эхогенная область с масс-эффектом, прилежащая к боковому желудочку. Свежая гематома обычно имеет неровные, но четкие края с гомогенным внутренним эхосигналом. Поскольку кровоизлияние начинается в области герминативного матрикса, то оно наиболее часто локализуется в лобно-теменной области. Эти НСГ-признаки более характерны для гематом малых или средних размеров. Крупные гематомы могут занимать большую часть одного или обоих больших полушарий и распространяться практически до поверхности головного мозга. В таких случаях определить первичную зону, из которой началось кровотечение, невозможно. Интрапаренхиматозное кровоизлияние всегда сочетается с внутрижелудочковым кровоизлиянием, так как эпендима значительно легче разрывается, чем неповрежденная паренхима мозга. В результате при НСГ возникают типичная эхогенная картина в мозговой паренхиме, изоэхогенность ткани в сечении полости желудочка, сливающаяся и неотличимая по плотности от сосудистого сплетения, и масс-эффект в виде смещения срединных структур мозга контралатерально.
Кровоизлияние в желудочках имеет четкий гладкий контур на фронтальном срезе, а вторичное интрапаренхиматозное кровоизлияние имеет неровные контуры. Исходом кровоизлияния IV степени бывают порэнцефалическая киста, сообщающаяся с боковым желудочком, и постгеморрагическая гидроцефалия.
Субдуральные кровоизлияния
Субдуральное кровоизлияние определяется как скопление анэхогенного или средней эхогенности содержимого в субдуральном пространстве. Имеет плоскую форму или форму полумесяца. Спонтанные субдуральные кровоизлияния у детей раннего возраста могут иметь совершенно неспецифическую клиническую картину и представлять большие диагностические сложности.
Перивентрикулярная лейкомаляция
Перивентрикулярная лейкомаляция представляет собой детский церебральный ишемический инфаркт (инсульт) паренхимы вследствие хронической гипоксемии или гипоперфузии. По данным НСГ, наиболее высока частота встречаемости перивентрикулярной лейкомаляции у детей старше шестидневного возраста, которые были рождены с низкой массой тела (от 900 до 2200 г). В целом перивентрикулярная лейкомаляция характерна для недоношенных новорожденных, в то время как у доношенных новорожденных страдают преимущественно серое вещество и базальные ганглии (в результате - глобальное уменьшение мозговой ткани или корковые атрофии).
Классическая картина перивентрикулярной лейкомаляции при НСГ проявляется в виде значительного повышения эхогенности вокруг обоих боковых желудочков, что легко определяется на всех срезах. В особо тяжелых случаях усиление зоны эхогенности распространяется над всеми боковыми желудочками, это уплотнение изоэхогенно сосудистому сплетению.
В большинстве случаев видна маленькая гематома внутри желудочка. Обычно перивентрикулярная лейкомаляция билатерально симметрична, но бывает и односторонней.
Выделяют две сонографические стадии перивентрикулярной лейкомаляции.
Первая стадия (1-2 нед) характеризуется симметричными полосами повышенной эхогенности (эхоструктура соответствует сосудистому сплетению) краниальнее и латеральнее бокового желудочка, четко отграниченными от окружающей паренхимы; редкостью одностороннего поражения; гипоэхогенной зоной шириной 1-2 мм, отделяющей поражение от боковых желудочков, которая исчезает при возникновении дополнительных внутрижелудочковых кровоизлияний; зоной повышенной эхогенности, обычно с неоднородными участками более высокой и более низкой эхогенности; в 1/4 случаев перивентрикулярная лейкомаляция сочетается с внутрижелудочковыми кровоизлияниями.
Вторая стадия (>3 нед) характеризуется участками повышенной эхогенности, содержащими множественные мелкие, диффузно расположенные перивентрикулярные кисты (чем больше окружность кисты, тем тяжелее клиническое течение); тенденцией к слиянию кист при более тяжелых формах поражения с образованием крупных кист с перегородками и сообщением с желудочками мозга; возникновением кист в областях головного мозга, которые до этого не демонстрировали гиперэхогенности; исчезновением мелких кист при легких формах перивентрикулярной лейкомаляции; развитием атрофии мозга с расширением внутренних и наружных ликворных пространств, преимущественно передних рогов боковых желудочков и межполушарной щели, - при тяжелых формах.
Сонографическая классификация по степени тяжести перивентрикулярной лейкомаляции предложена De Vries [5].
Ишемические поражения базальных ганглиев
В отличие от перивентрикулярной лейкомаляции, характерной для недоношенных новорожденных, ишемические поражения базальных ганглиев чаще наблюдаются у доношенных детей. Ишемические очаги могут наблюдаться как с обеих сторон (чаще), так и с одной стороны, при этом для очага ишемии характерны невыраженное повышение эхогенности и нечеткость контура. Размеры очагов ишемии в базальных ганглиях могут быть различными - от 5 до 15 мм. При динамическом наблюдении в течение 4-6 нед эти участки обычно бесследно исчезают.
Помимо вышеописанной патологии, НСГ применяют для диагностики врожденных пороков развития головного мозга (обструкции ликворопроводящих путей, врожденной гидроцефалии, агенезии мозолистого тела, диспластической атрофии головного мозга, кольпоцефалии, аномалии Арнольда-Киари, аномалии Денди-Уокера и др.), сосудистых мальформаций, кальцификатов (например, вследствие врожденного токсоплазмоза, врожденной краснушной нейроинфекции) как у новорожденных и детей раннего возраста [2-4], так и у плода [14].
Список литературы
-
Васильев А.Ю., Ольхова Е.Б. Ультразвуковая диагностика в неотложной детской практике. М.: ГЭОТАР-Медиа, 2010. 832 с.
-
Ватолин К.В. Ультразвуковая диагностика заболеваний головного мозга у детей. М.: Видар, 1995. 129 с.
-
DeVries L.S., Eken P., Dubowitz L.M. The spectrum of leukomalaciausingcranialultrasound // Behav. Brain. Res. 1992. Vol. 49. P. 1-6.
-
Seigel M. Pediatric sonography. 3rd ed. Philadelphia, PA: Lippincott Williams and Wilkins, 2002. 749 p.
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ПЕРИФЕРИЧЕСКОЙ НЕРВНОЙ СИСТЕМЫ
Н.А. Еськин, Н.Ю. Матвеева
Введение
В настоящее время такие инструментальные методы исследования, как ЭНМГ, УЗИ, МРТ и КТ-миелография используются клиницистами для получения информации о структуре, а также о повреждениях и заболеваниях периферических нервов. В оценке функционального состояния периферического нерва незаменимым методом является электронейромиография. Но данные ЭНМГ не всегда позволяют точно определить локализацию, характер и степень (полное или частичное) повреждения периферического нерва, судить об изменении структуры травмированного участка нервного ствола. Располагая результатами только ЭНМГ, невозможно оценить состояние окружающих тканей, характер и протяженность их изменений.
Ультразвуковая неврология - относительно новый раздел в современной сонографии. Этот метод стал применяться в диагностике заболеваний нервной системы с 90-х годов прошлого столетия. Традиционно методом выбора для визуализации периферических нервов считали магнитно-резонансную томографию, обладающую высокой разрешающей способностью в отношении мягкотканных структур. Однако томография не всегда в состоянии решить поставленные перед клиницистами задачи и имеет ряд недостатков, ограничивающих ее применение. К ним можно отнести дороговизну метода, невозможность проведения функциональных проб во время исследования. Кроме того, магнитно-резонансная томография не может быть использована у пациентов с инородными металлическими телами (водители ритма, эндопротезы, кава-фильтры и т.д.), ожирением III-IV степени, клаустрофобией.
Ультразвуковой метод относительно дешев, доступен, исследование возможно повторять необходимое число раз. В процессе обследования специалист может оценить структуру нервного ствола и окружающих тканей на протяжении, провести динамические пробы, а также использовать различные способы улучшения ультразвуковой визуализации.
Для ультразвукового исследования периферических нервов можно использовать любой ультразвуковой сканер, имеющийся в медицинском учреждении. Оговоримся, что разумеется, от «класса» УЗ-аппарата будет зависеть и качество получаемой специалистом информации. Для визуализации периферических нервов в основном используют датчики средней и высокой частоты (7-17 МГц), что обусловлено преимущественно поверхностным расположением нервных стволов и их небольшим диаметром. Чем меньше диаметр исследуемого нерва (пальцевые, поверхностные кожные ветви), тем выше частота датчика - от 15 МГц и выше. Напротив, при исследовании крупных периферических нервов (седалищного, бедренного), можно использовать низкочастотные датчики с частотой 3-5 МГц.
Показания к использованию УЗ-исследования периферических нервов и плечевого сплетения
-
очаговая неврологическая симптоматика, диагностируемая непосредственно после получения травмы (подозрение на повреждение периферического нерва);
-
очаговая неврологическая симптоматика, выявленная при клиническом осмотре больных с различными хроническими заболеваниями;
-
ультразвуковой контроль в послеоперационном периоде при вмешательствах, проводившихся на периферических нервах (невролиз, нейрорафия, аутопластика и т.д.) и в непосредственной близости от нервного ствола.
Противопоказаний к использованию метода нет. УЗ-исследование может выполняться необходимое количество раз, продолжительность исследования не ограничена.
Осложнений УЗ-исследования не описано.
Методика ультразвукового обследования периферических нервов
Общие принципы
Локацию любого нерва нужно начинать в той точке, где его проще всего обнаружить, со своеобразного топографического ориентира. Сканирование осуществляют, в основном, в поперечной проекции. После получения четкого изображения нерва его исследуют в проксимальном и дистальном направлениях. При этом датчик скользящими движениями перемещают по поверхности кожи, а изображение нерва в поперечном сечении удерживают в центре экрана.
Исследование нервных стволов в продольной проекции часто бывает затруднено из-за плохой дифференцировки нерва от окружающих его мягких тканей - сухожилий и мышц. Тем не менее этой проекцией не следует пренебрегать и сканирование обязательно должно быть полипозиционным.
затем Если во время исследования выявлен участок нарушения нормальной структуры нерва, необходимо провести детальное изучение этой области. Оценивают форму, протяженность, характер изменений, соотношение нерва с окружающими тканями, особенности кровотока в этой зоне, с целью получения максимально возможной информации, которая может помочь в установлении верного диагноза.
Проводить измерения участков неизмененного нерва (определение диаметра, площади поперечного сечения и т.д.) - это трудоемкий и малоинформативный процесс. Показатели размеров нерва вариабельны и зависят от пола, возраста, конституции обследуемого. В силу указанных причин выявленные параметры не являются значимыми и никак не влияют на конечное суждение о диагнозе. Тем не менее размеры нерва в области патологических изменений необходимо сравнивать с аналогичным участком нервного ствола на «здоровой» стороне. Это помогает специалисту определиться с тем, каковы нормальные параметры исследуемого нерва у конкретного пациента.
Ультразвуковая структура нерва имеет ряд характерных признаков. При сканировании в поперечной проекции нерв выглядит как образование округлой или овальной формы с достаточно четким контуром. Внутри образования можно увидеть округлые гипоэхогенные включения, также имеющие четкие контуры. В научной литературе встречаются такие образные выражения, как «медовые соты» или «соль-перец», хорошо характеризующие особенности эхографической картины, которую наблюдает врач при локации нервного ствола (рис. 11.66, а). При продольном сканировании структура нерва также упорядочена и представлена чередующимися гипер- и гипоэхогенными линейными полосами с четким гиперэхогенным контуром («электрический кабель») (рис. 11.66, б).
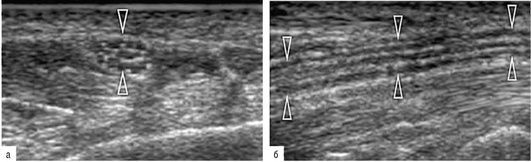
Рис. 11.66. Ультразвуковое изображение периферического нерва (срединный нерв) в норме: а - на поперечном ультразвуковом срезе нерв (головки стрелок) представлен как округлая, пористая структура (по типу сот), состоящая из округлых гипоэхогенных зон, окруженных гиперэхогенными оболочками. Внешний эпиневрий (головки стрелок) позволяет определить внешние границы нерва; б - при продольном сканировании фасцикулярная эхоструктура нерва (головки стрелок) состоит из параллельных линейных гипоэхогенных полос (нейронные пучки), которые идут параллельно друг другу, разделенные гиперэхогенными полосами (внутрифасцикулярный эпиневрий)
Эхохарактеристики нормального периферического нерва полностью отражают его гистологическое строение. Гипоэхогенные продольные структуры соответствуют нервным пучкам, состоящих из различного количества нервных волокон. Пучки окружены собственной соединительнотканой оболочкой (периневрием), через который происходит основное «питание» нервных пучков. Весь нервный ствол окружен соединительной тканью - эпиневрием. В структуре нерва соединительная ткань на ультразвуковом изображении соответствует гиперэхогенным участкам. В норме интенсивность кровотока в периневрии и эпиневрии настолько мала, что при цветовом допплеровском картировании не удается получить сколь-нибудь достоверных эхосигналов. Напротив, при воспалительных процессах в нервном стволе, компрессионных невропатиях (обычно выше места сдавления) в толще нерва в режиме ЦДК может регистрироваться неинтенсивный кровоток.
Оболочку неизмененного нерва отдельно визуализировать, как правило, не удается, исследователь оценивает лишь контуры нервного ствола. В случаях компрессионного воздействия на нерв, хронического воспаления в окружающих мягких тканях, при повреждениях нерва оболочка нерва становится более плотной и при УЗ-исследовании выглядит как гиперэхогенная яркая структура, окружающая нервный ствол. При травмах периферического нерва оболочка нерва может быть повреждена и в зоне травмы исследователь отмечает нечеткость контуров нервного ствола, прерывистость оболочки.
В процессе УЗ-исследования специалист может визуализировать практически любой периферический нерв на верхней и нижней конечности. Ограничение метода связано с подготовленностью специалиста УЗ-диагностики, знанием им анатомии обследуемой области. Безусловно, еще один определяющий фактор - класс УЗ-сканера (для исследования нервов очень малого диаметра (менее 2 мм), необходима установка экспертного класса и наличие датчиков необходимой частоты. К объективным сложностям визуализации периферических нервов могут быть отнесены также следующие причины. Первое - это анатомические особенности расположения нервного ствола, а именно малый диаметр нерва в сочетании его с «глубоким» расположением в межфасциальных пространствах под крупными мышцами. Второе - отсутствие четких УЗ-ориентиров, по которым исследователь может со всей определенностью заключить, что он лоцирует именно этот нерв. И третье - наличие костных препятствий по ходу нервного ствола. Перечисленные ограничения использования УЗ-метода касаются таких нервов, как надлопаточный, подкрыльцовый, длинный грудной нерв, передний и задний межкостный нервы, проксимальные отделы седалищного, бедренного нервов и конечные ветви бедренного нерва. Но, тем не менее, в каждом конкретном случае надо пытаться визуализировать нерв, максимально прилагая для этого усилия. Необходимо помнить, что каждый пациент по своему уникальный случай и что невозможно увидеть у одного больного, хорошо лоцируется у другого.
Ультразвуковая диагностика заболеваний периферических нервов
Повреждения периферических нервов
Травматические повреждения нервов могут быть разделены на две большие группы:
Ультразвуковая картина при повреждениях нервов имеет характерные признаки в зависимости от вида повреждения и является общей для любого из периферических нервов и элементов плечевого сплетения. Причины нарушения целостности нервного ствола могут быть различны: пересечение нерва в результате резаной раны, повреждение отломками кости или ущемление нерва между ними при переломах со смещением, сдавление нерва рубцовой тканью или костной мозолью, тракция или ушибы нервных стволов при различный травмах. Кроме этого, может произойти ятрогенное повреждение нерва при закрытой или открытой репозиции отломков, операциях остеосинтеза, при оперативном вмешательстве на прилежащих непосредственно к нервному стволу мягких тканях.
Травмы плечевого сплетения встречаются преимущественно у молодых людей, как правило, имеют в своей основе тракционный генез и характерны для контактных видов спорта, мотоаварий.
На верхней конечности чаще всего встречаются повреждения лучевого нерва, связанные с переломом плечевой кости, что, прежде всего, объясняется близким прилеганием нерва к кости при прохождении через спиральный канал плечевой кости. На нижней конечности наиболее уязвимой в этом отношении областью является головка малоберцовой кости, где ее огибает общий малоберцовый нерв.
Заключение о нарушении анатомической целостности нерва может быть сделано на основании визуализации дистального и проксимального концов нерва с отчетливо выявляемым диастазом между ними (рис. 11.67). При этом в первые дни после травмы разъединенные сегменты нерва, как правило, не изменены и лишь по прошествии некоторого времени (в среднем через 2-3 нед) чаще всего в проксимальном конце поврежденного нервного ствола формируется посттравматическая неврома. Дистальный конец полностью поврежденного нерва истончается при длительном перерыва нерва и в нем также могут образовываться травматические невромы (рис. 11.68). Истончение дистального конца поврежденного нервного ствола и нервных волокон в его составе трактуются как дегенеративные изменения периферического нерва.
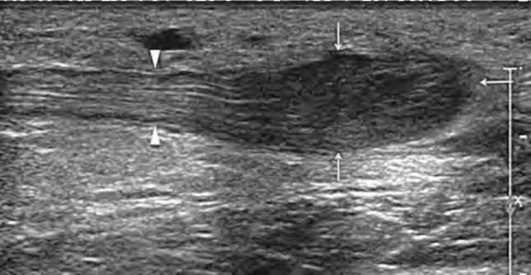
Рис. 11.67. Продольное ультразвуковое исследование пациента через 3 мес после травматического повреждения срединного нерва. Выявлена нормальная пучковая структура нерва (головки стрелок), но в проксимальном конце поврежденного нерва лоцируется веретенообразное изменение его формы. Культя нерва после полного пересечения заметно утолщена из-за формирования невромы терминального типа (стрелки) с гипоэхогенной внутренней архитектоникой
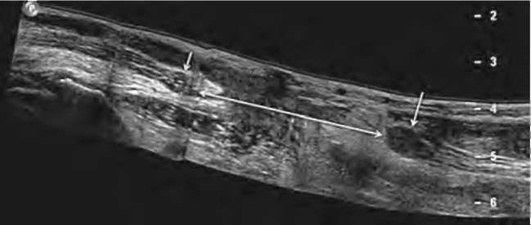
Рис. 11.68. Панорамное сонографическое изображение травматического повреждения срединного нерва в дистальном отделе предплечья. Хорошо визуализируются проксимальная (короткая стрелка) и дистальная (длинная стрелка) культи нерва с явным набуханием и дезорганизацией нервных элементов в проксимальной культе вследствие формирования невромы. Панорамное изображение демонстрирует большой диастаз между культями нерва (двойная стрелка)
При подозрении на частичное повреждение периферического нерва особое внимание необходимо обращать на целостность оболочки нерва и структуру нервных волокон в месте травмы. При частичном повреждении нарушается непрерывность нервных волокон, что особенно хорошо видно при продольном сканировании - лоцируется линейная гипоэхогенная зона, в которой отдельные нервные волокна не прослеживаются. При поперечном сканировании в травмированном участке нерва характерная структура «соль - перец» утрачивается и также замещается гипоэхогенной зоной.
Травматические невромы в зависимости от локализации образования и причины, их вызвавшей (полный или частичный разрыв), делятся на терминальные, краевые и внутриствольные (рис. 11.69). Структура невромы гипоэхогенна и однородна, размер невромы зависит от размера поврежденного нерва и количества вовлеченной в повреждение нервной ткани. Образование имеет четкие контуры, овальную или округлую форму и аваскулярно - в режиме ЦДК кровоток в невроме не регистрируется. При частичном повреждении целостности нерва в поврежденной нервной ткани, как уже было указано выше, может сформироваться внутриствольная или краевая неврома. В этом случае образование визуализируют непосредственно в нервном стволе или по его контуру, оно имеет такие же ультразвуковые характеристики, как и при полном перерыве ствола. Размеры невромы вариабельны и могут достигать нескольких сантиметров в длину. В ультразвуковом заключении необходимо указать диастаз между концами поврежденного нерва, структуру проксимального и дистального концов, размеры невромы, ее локализацию. При частичном повреждении нерва необходимо описать сохраненную нервную ткань.
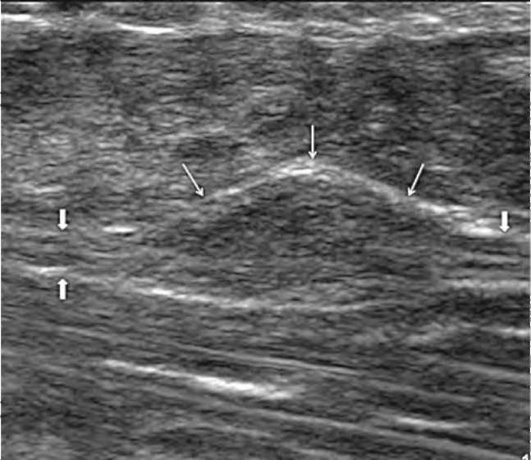
Рис. 11.69. Внутриствольная неврома. Пациент после тупой травмы локтевого нерва. При продольном ультразвуковом исследовании определяется локальное веретонообразное расширение нерва (тонкие стрелки) с изоэохенной структурой. Проксимальнее и дистальнее образования визуализируется неизменный локтевой нерв (стрелки)
При контузии нерва или его тракции в случае сохранения целостности наружной оболочки, изменяется внутренняя структура нервного ствола. Происходит утрата дифференцировки на отдельные волокна и нерв становится гипоэхогенным, неравномерно утолщенным с нечетким контуром, дифференцировка на волокна утрачивается (рис. 11.70, а, б). Морфологически вышеуказанные изменения в структуре нерва соответствуют внутриствольной гематоме в месте повреждения. В то же время в проксимальном и дистальном направлении нервный ствол, как правило, не изменен. В исходе такой травмы нервный ствол в зоне повреждения заполняется гипоэхогенной зоной, которая соответствует участку рубцовой ткани либо внутриствольной невроме. Дифференциальная диагностика в этом случае крайне трудна и часто окончательный диагноз получается поставить только на основании гистологического заключения в случае оперативного смешательства.
В месте ущемления нервного ствола между костными фрагментами или металлоконструкциями отмечают истончение нерва непосредственно в месте поражения и утрату упорядоченности эхоструктуры (рис. 11.71). Такую же картину можно увидеть в случаях сдавления нерва рубцовой тканью или костной мозолью. Проксимальнее места сдавления диаметр нерва увеличивается за счет утолщения отдельных нервных пучков в его составе. Ствол при этом имеет нечеткие контуры и структуру пониженной эхогенности. Описанные ультразвуковые признаки обусловлены отеком проксимального по отношению к сдавленному участку сегмента нерва. Дистальнее места повреждения структура нерва может быть не изменена. При длительно существующей компрессии дистальный конец нерва дегенеративно мененяется.
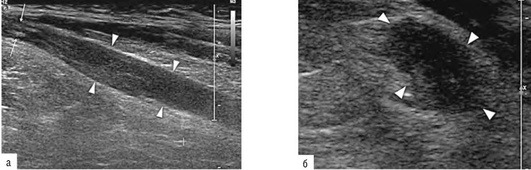
Рис. 11.70. Ультразвуковое исследование тракционного повреждения малоберцового нерва: а - при продольном сканировании проксимальнее головки малоберцовой кости визуализируются частично сохраненная пучковая структура нерва (тонкие стрелки). Дистальнее - изменение формы нерва и резкое снижение эхогенности внутренней структуры (головки стрелок) из-за внутриствольной гематомы; б - поперечная сонограмма зоны повреждения (головки стрелок). Определяется практически анэхогенная структура участка повреждения нерва. По периферии лоцируются сохраненные нервные волокна
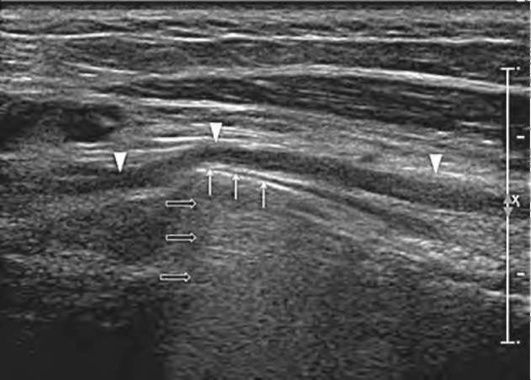
Рис. 11.71. Пациенту с переломом плечевой кости произведен остеосинтез накостной пластиной. После операции появились признаки невропатии лучевого нерва. При продольном ультразвуковом исследовании было выявлено, что деформация прямолинейного хода лучевого нерва (головки стрелок) с признаками компрессии гиперэхогенным линейным включением (пластина - тонкие стрелки) и наличием реверберации за ней (черные стрелки)
Синдромы сдавления периферических нервов (туннельные синдромы)
Периферические нервы конечностей могут подвергаться сдавлению в естественных фиброзных каналах, при расположении в толще мышечной ткани и в случае прилегания к кости. Ниже перечислены основные места сдавления периферических нервов верхней и нижней конечности.
Верхняя конечность
Срединный нерв:
Локтевой нерв:
Лучевой нерв:
Нижняя конечность
Большеберцовый нерв:
Общий малоберцовый нерв:
Латеральный кожный нерв бедра:
УЗ-признаки развития компрессионной невропатии часто схожи и не зависят от локализации развития компрессионного синдрома. Наиболее распространенный случай компрессионной невропатии - это сдавление срединного нерва на уровне кистевого сустава - синдром «карпального канала». Данное заболевание имеет характерную клиническую картину, при этом диагноз далеко не всегда устанавливается сразу. Часто чувство «онемения» и боли в руке принимают за симптомы шейного остеохондроза. В этом случае ультразвуковое исследование, наряду с электронейромиографией, помогает повести дифференциальную диагностику и выявить сдавление срединного нерва в карпальном канале.
Основные причины развития карпального туннельного синдрома следующие:
-
сдавление срединного нерва утолщенной карпальной связкой (изменения структуры связки могут быть обусловлены травмой, хроническим воспалением, эндокринными нарушениями и т.д.);
-
уменьшение объема карпального канала, вызванное суставными ганглиями, экзостозами, остеофитами, теносиновитами сухожилий сгибателей пальцев и т.д.;
-
варианты строения срединного нерва (сопровождение нерва артерией, «глубокое» расположение срединного нерва в карпальном канале между сухожилиями сгибателей).
К основным ультразвуковым признакам синдрома карпального канала относятся: утолщение срединного нерва проксимальнее карпального канала и в проксимальном отделе карпального канала, появление кровотока в толще нервного ствола в режиме ЦДК, уплощение или снижение высоты нерва в карпальном канале, утолщение и уплотнение оболочки срединного нерва в карпальном канале, утолщение и изменение структуры карпальной связки (удерживателя сгибателей) (рис. 11.72, а, б).
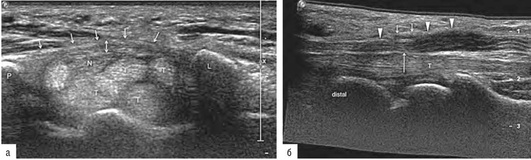
Рис. 11.72. Невропатия срединного нерва на уровне кистевого сустава (синдром карпального канала): а - поперечный срез демонстрирует утолщенную lig. retinaculum (стрелки), которая с лучевой стороны прикрепляется к бугристости ладьевидной кости и к кости трапеции (L), а с локтевой стороны - к гороховидной кости и крючку крючковидной кости (Р). Срединный нерв (N) уплощен, вокруг него и под ним располагаются сухожилия сгибателей пальцев кисти (Т); б - продольное ультразвуковое сканирование демонстрирует утолщенную lig. retinaculum (маленькие стрелки), которая приводит к сдавлению срединного нерва (длинная стрелка). Проксимальнее и дистальнее места компрессии нерва отмечается увеличение его диаметра со снижением внутренней эхоструктуры (головки стрелок), больше выраженное в проксимальном отделе
Итак, проксимальнее карпального канала срединный нерв теряет дифференцировку на волокна и структура его становится гипоэхогенной. В ряде зарубежных исследований, посвященных проблеме ультразвуковой диагностики синдрома «карпального канала», подчеркивается необходимость объективизации изменений размеров срединного нерва. По данным метаанализа, увеличение площади поперечного сечения срединного нерва свыше 0,1 см2, измеренной на уровне гороховидной кости, считается самым чувствительным показателем сдавления нерва в карпальном канале. Кроме того, используются такие показатели, как коэффициент уплощения, определяемый как отношение максимальной ширины нерва к его высоте (значения выше 3,3 принимают за патологические), толщина карпальной связки больше 0,08 см. Появление внутриневральной гиперваскуляризации проксимальнее места компрессии срединного нерва при исследовании в режиме ЦДК, также может свидетельствовать о развитии синдрома «карпального канала». Таким образом, при обследовании срединного нерва на уровне кистевого сустава необходимо задействовать весь спектр диагностических возможностей сонографии и, в сложных случаях, заключение о компрессии нерва выносится на основании совокупности выявленных патологических признаков.
Вторым по распространенности является синдром сдавления локтевого нерва в кубитальном канале.
Основные причины возникновения этого туннельного синдрома следующие:
-
дислокация локтевого нерва на уровне локтевого сустава (вывих и гипермобильность нерва);
-
наличие «добавочной» мышцы в кубитальном канале, гипертрофия медиальной головки трицепса плеча;
-
деформация суставных поверхностей локтевого сустава, остеофиты, выпот в полости локтевого сустава различного генеза.
Истинное ущемление в локтевой борозде происходит при сдавлении нерва рубцовой тканью, костной мозолью, экзостозами или мягкотканными образованиями, такими как организовавшаяся гематома, интраневральные ганглии и внурисуставные ганглии, добавочная локтевая мышца. Внешняя компрессия нерва может развиться при наличии предрасполагающих факторов: мелкой бороздки локтевого нерва, длительного давления на область кубитального канала или подвывих и вывих нерва у пациентов посттравматического или любого другого генеза. Повторяющийся вывих локтевого нерва со смещением его на заднюю и медиальную поверхность медиального надмыщелка плечевой кости может вызвать повреждение нерва или провоцировать постоянную его травматизацию.
Ультразвуковое исследование локтевого нерва при подозрении на сдавление нерва в кубитальном канале начинают в поперечной проекции с дистального отдела плеча. Обычно на этом участке нерв имеет овальную форму, при прохождении через кубитальный канал она становится округлой. Следует еще раз подчеркнуть, что у обследуемых пациентов может отмечаться некоторое снижение эхогенности локтевого нерва в этой зоне и небольшое увеличение его размеров без клинических симптомов невропатии. В отличие от здоровых субъектов, у больных с синдромом кубитального канала увеличение диаметра локтевого нерва находят также и на уровне медиального надмыщелка плеча.
После обследования нерва в кубитальном канале в поперечной и продольной проекциях датчик смещают дистальнее и оценивают структуру нерва в проксимальных отделах предплечья. К основным ультразвуковым признакам синдрома сдавления локтевого нерва в кубитальном канале относят уплощение нерва непосредственно в месте компрессии, утолщение его выше этой зоны, утрату внутренней дифференцировки нерва на отдельные волокна, отек окружающих мягких тканей и гиперваскуляризацию.
При хронической травматизации локтевого нерва в кубитальном канале клинические проявления не отличаются от таковых при сдавлении нерва в этой области, а данные ультразвукового исследования будут иметь другие характерные признаки. Основным из них служит диффузное утолщение нерва на уровне кубитального канала. Кроме того, можно обнаружить увеличение размеров отдельных нервных пучков в составе нерва, размытость контура нерва за счет отека окружающих мягких тканей. При этом проксимальнее и дистальнее кубитального канала структура нерва может быть не изменена.
Компрессия локтевого нерва в канале Гийона встречается значительно реже, чем синдром «кубитального канала». Основными причинами ущемления локтевого нерва в канале Гийона являются внешнее сдавление различными образованиями: липомой, внутрисуставным ганглием, аневризмой локтевой артерии (рис. 11.73). Этот вид туннельного синдрома редок и ультразвуковые признаки сдавления локтевого нерва в канале Гийона совпадают с описанными выше при других компрессионных невропатиях.
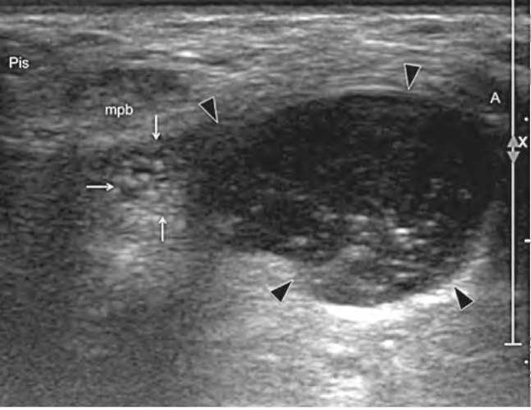
Рис. 11.73. Ганглий канала Гийона. Поперечное ультразвуковое исследование локтевого нерва на уровне канала Гийона выявило округлое гипоэхогенное образование с четкими краями (головки стрелок), плотно прилегающее к нерву (тонкие стрелки). Данное образование имеет усиленный акустический сигнал в задней части (стрелки). Обозначения: Pis - гороховидная кость; mpb - короткая отводящая мышца 5 пальца; А - артерия
Самым часто встречающимся туннельным синдромом на нижней конечности является синдром сдавления общего малоберцового нерва на уровне верхнего мышечно-малоберцового канала. Причины возникновения этого туннельного синдрома следующие:
-
сдавление общего малоберцового нерва извне (ганглием из проксимального межбецового сустава, гипсовой лонгетой, в случае переломов головки малоберцовой кости, при длительном вынужденном положении конечности);
-
травмы коленного сустава (в этом случае, как правило, имеет место тракционный характер повреждения общего малоберцового нерва);
УЗ-исследование общего малоберцоваого нерва начинают от места его формирования от седалищного нерва - как правило, на уровне верхнего угла подколенной ямки. Структура нерва на уровне подколенной ямки, как правило, не изменена. Проксимальнее места компрессии в верхнем мышечно-малоберцовом канале нерв может быть утолщен за счет утолщения волокон в составе нервного ствола, пониженной эхогенности.
При УЗ-исследовании в месте компрессии высота нерва снижена, дифференцировка на волокна не выражена, оболочка нерва уплотнена, гиперэхогенна. Особое внимание следует уделить структуре окружающих мягких тканей - как правило, отмечается повышение эхогенности, «уплотнение» тканей. Кроме того, в некоторых случаях исследователь может выявить уменьшение расстояния от нерва до головки малоберцовой кости по сравнению с противоположной стороной.
При отсутствии компрессионного воздействия на общий малоберцовый нерв, когда причиной возникновения туннельного синдрома является постоянная микротравматизация нервного ствола, УЗ-картина будет иной. В верхнем мышечно-малоберцовом канале и проксимальнее нерв будет утолщен по сравнению с противоположной стороной, гипоэхогенен. При этом изменений в структуре оболочки нервного ствола исследователь может не выявить. Окружающие мягкие ткани также могут быть структурно не изменены.
Из всего вышесказанного становится понятно, что УЗ-диагноз фибулярного туненельного синдрома сложен и во многом субъективен. В этом случае многое зависит от опыта и навыков специалиста УЗ-диагностики. Тем не менее в сочетании с данными ЭНМГ, объективного осмотра и анамнеза пациента именно сонография предоставляет клиницисту дополнительную информацию о структуре общего малоберцового нерва. Часто эти сведения являются определяющими для решения вопроса о диагнозе и дальнейшей тактике лечения больного.
При исследовании медиального отдела голеностопного сустава необходимо помнить о таком виде патологии, как синдром тарзального канала. Этот вид туннельной невропатии связан со сдавлением большеберцового нерва в тарзальном канале. Тарзальный канал на стопе аналогичен по своей структуре карпальному каналу на кисти. Сухожилия сгибателей и сосудисто-нервный пучок заключены в довольно тесное пространство между медиальной лодыжкой, таранной костью и удерживателем сгибателей. При повышении давления в этом пространстве происходит компрессия большеберцового нерва, что клинически проявляется болью и парестезиями в медиальном отделе стопы.
Основные причины возникновения синдрома тарзального канала следующие:
Ультразвуковая диагностика этого туннельного синдрома основывается на выявлении дополнительных образований в тарзальном канале: скопление жидкости, внутрисуставной ганглий и т.д. Эти причины вызывают сдавление и уплощение большеберцового нерва. Выше зоны компрессии мы отмечаем утолщение нервного ствола с ультразвуковыми признаками его отека.
Диагностика туннельных синдромов - одна из самых часто встречающихся задач, с которыми сталкиваются специалисты УЗ-диагностики. Мы остановились на наиболее распространенных компрессионных невропатиях, но применение УЗ-метода этим не ограничивается. Основные принципы визуализации в диагностике туннельных синдромов могут быть применены при любой локализации сдавления периферического нерва.
Объемные образования периферических нервов
Шванномы и нейрофибромы - самые распространенные опухоли периферических нервов. Так, по данным Dart и Lusk, плечевое сплетение поражается нейрофибромой в 50-65% случаев и шванномой в 18-20% случаев. Периферические нервы верхней конечности поражаются чаще, чем нервы нижней конечности.
Шваннома - опухоль, исходящая из шванновских клеток миелиновой оболочки нерва, встречается наиболее часто и поражает лиц в возрасте от 30 до 50 лет чаще женщин. Надо отметить, что ультразвуковые признаки шванном и нейрофибром имеют сходные черты - выявляют гипоэхогенные структуры овальной или веретенообразной формы, ориентированные по длинной оси нерва и дающие эффект дорсального усиления. Однако существуют УЗ-признаки, позволяющие исследователю сделать предположение о морфологическом строении опухоли. Для шванном характерны четкость и ровность контуров, наличие гиперэхогенной капсулы. Структура шванномы неоднородна, гипоэхогенна, при ультразвуковом исследовании могут выявляться жидкостные включения (признаки «старой» шванномы). Опухоль исходит из оболочки нерва, поэтому специалист может лоцировать сохраненные нервные волокна, смещенные образованием (рис. 11.74). Размеры опухоли вариабельны и колеблются от 2 см.
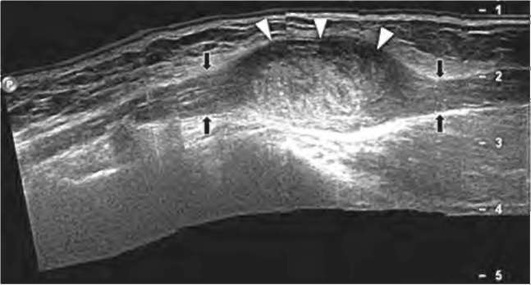
Рис. 11.74. Шваннома локтевого нерва. Понорамное сканирование по длинной оси локтевого нерва визуализирует объемное образование, овальной или веретенообразной формы. Данное образование расположено эксцентрично к длинной оси нерва (головки стрелок). В проксимальном и дистальном отделах опухоль отчетливо выявляется связь с нервом, дифференцировка на волокна сохранена (стрелки)
Опухоль характеризуется концентрическими гипоэхогенными и гиперэхогенными слоями.
При нейрофиброме опухоль формируется из оболочки нерва, не имеет четких границ, может достигать значительных размеров. Чаще нейрофибромы выявляются у молодых людей, страдающих нейрофиброматозом 1-го типа. Нейрофибромы четких контуров и капсулы не имеют, структура нейрофибром гипоэхогенна, неоднородна. Опухоль имеет продолженный рост и очень трудно определить границу распространения опухолевого процесса. Контуры нерва в месте расположения опухоли неровные, нерв диффузно утолщен, отдельные нервные волокна неравномерной толщины и плохо дифференцируются друг от друга (рис. 11.75, а, б, см. @+). В режиме цветовой допплерографии в опухоли, как правило, васкуляризация не регистрируется (отметим, что для шванном характерна васкуляризация в режиме ЦДК, хотя этот признак и не может рассматриваться как патогномоничный - (рис. 11.76, см. @+). Необходимо помнить, что объем оперативного вмешательства на нервном стволе при шванномах и нейрофибромах различен. Шванномы легко выделяются из оболочки и нерва с капсулой и нервные волокна остаются сохранными, функция нерва после оперативного вмешательства не нарушается. При нейрофиброме необходимо резецировать нервный ствол с опухолью и замещать дефект нерва аутотрансплантатом. Поэтому на УЗ-исследовании (наряду с другими методами визкализации, прежде всего МРТ) лежит ответственность за определение тактики лечения пациента.
Злокачественные опухоли периферических нервов, как правило, поражают крупные нервные стволы, такие как седалищный нерв или плечевое сплетение. Кроме того, у больных со злокачественными опухолями чаще есть очерченная неврологическая симптоматика, что практически не встречается у пациентов, имеющих доброкачественные опухоли. Такие ультразвуковые признаки, как размеры опухоли более 5 см, быстрое прогрессирование, нечеткость контуров, гетерогенность структуры образрвания с наличием кальцинатов и реакция окружающих тканей в виде отека и инфильтрации вероятнее всего свидетельствуют о злокачественности процесса. Вышеперечисленные характеристики (за исключением указаний на инвазивный рост) не являются специфичными и не позволяют сделать однозначный вывод о природе опухоли. Специалисту УЗ-диагностики в ходе исследования необходимо дать однозначный ответ на вопрос, исходит ли образование из нервного ствола, и максимально точно описать структуру образования, его размеры, контуры, расположение, состояние окружающих мягких тканей. На основании полученных данных обследования исследователь должен высказать свои предположения относительно характера выявленного объемного образования и составить дифференциально-диагностический ряд по результатам проведенного обследования.
К опухолеподобным заболеванием периферических нервов относятся периневральные ганглии и неврома Мортона.
Неврома Мортона (периневральный фиброз, фокальный травматический неврит подошвенного нерва) является фиброзным утолщением межпальцевого нерва и относится к опухолеподобным поражениям нервных стволов. Преимущественная локализация этой опухоли между III и IV плюсневой костью имеет анатомическое обоснование: здесь образуется своего рода нервное сплетение из разветвления общего подошвенного нерва третьего межпальцевого промежутка и ветвями анастомоза от латерального подошвенного нерва. Ультразвуковое обследование межпальцевых пространств между пальцами ног лучше всего проводить со стороны подошвенной поверхности, при этом датчик устанавливается в поперечной плоскости на уровне головок плюсневых костей. Опыт наших исследований показывает, что только поперечного исследования стопы недостаточно, поэтому необходимо проведение также и продольного ультразвукового сканирования данной области. В некоторых случаях бывает полезным продольное и поперечное сканирование стопы с тыльной поверхности. Для исследований целесообразно использовать датчики с частотой не менее 9 МГц. Нормальное межпальцевое пространство характеризуется наличием эхогенного материала, включающего жир и соединительную ткань. В некоторых случаях в межпальцевом пространстве может лоцироваться жидкостное образование с четкими контурами - межплюсневая сумка. Размеры сумки в норме не превышают 0,6×0,3 см. Неврома имеет округлую или веретенообразную форму и гипоэхогенную структуру, определяющуюся в нижней части межплюсневого пространства между головками плюсневых костей. Всегда следует пытаться установить связь выявленного образования с межпальцевым нервом, что сразу повышает специфичность сонографического исследования. Из-за малого размера подошвенного нерва и глубины его расположения достигается это далеко не всегда. Неврому можно спутать с воспалением в прилежащей межплюсневой сумке. Ультразвуковые отличия состоят в том, что плюсневая сумка расположена кпереди от межпальцевого нерва между плюсневыми головками и при воспалении сумки в ней, как правило, присутствует неоднородная жидкость. Кроме того, клиническая симптоматика невромы Мортона достаточно характерна для того, чтобы заподозрить именно это заболевание.
Периневральный ганглий также относится к опухолеподобным поражениям периферического нерва. Чаще всего выявляются ганглии общего малоберцового нерва на уровне коленного сустава и локтевого нерва на уровне локтевого сустава. Это обусловлено особенностями топографической анатомиии - чаще всего ганглии, исходящие из проксимального межберцового сустава или локтевого сустава, «мигрируют» под оболочку общего малоберцового или локтевого нервов соответственно в тех зонах, где нервы прилежат к суставным поверхностям. При УЗ-исследовании периферических нервов лоцируется жидкостная структура, расположенная под оболочкой нерва либо исходящая из оболочки. Жидкость может окружать отдельные нервные волокна и распространяться по периневрию в проксимальном и дистальном направлениях. Нерв в этой зоне неравномерно утолщен, контуры остаются четкими, окружающие нерв мягкие ткани структурно не изменены. При УЗ-исследовании часто удается установить связь выявленного жидкостного образования с полостью сустава. Наличие периневрального ганглия, как правило, сопровождается клиническими симптомами невропатии периферического нерва.
Заключение
Ультразвуковое исследование периферической нервной системы с каждым годом приобретает все большее значение в клинической практике. К неоспоримым преимуществам сонографии по сравнению с другими методами визуализации относятся относительная дешевизна исследования и возможность повторять его необходимое число раз. В процессе обследования специалист может не только оценить структуру нервного ствола на протяжении и состояние окружающих тканей, но и провести ряд динамических проб.
Диагностическая ценность ультрасонографии периферических нервов требует дальнейшего изучения и проведения дополнительных исследований. Опыт нашей клиники свидетельствует о том, что при травме периферических нервов и плечевого сплетения, выявленных объемных образованиях периферических нервов ультразвуквое исследование демонстрирует высокую точность диагностики даже по сравнению с таким общепризнанным методом визуализации, как МРТ. Сонографические признаки невропатии периферических нервов необходимо трактовать с известной долей осторожности, опираясь на данные функциональных методов исследования, прежде всего электронейромиографии, и клиническую картину заболевания. Широкое использование ультразвукового метода в диагностике заболеваний и повреждений периферических нервов и плечевого сплетения будет способствовать повышению эффективности оказания медицинской помощи у данной категории пациентов.
Список литературы
-
Еськин Н.А., Голубев В.Г., Богдашевский Д.Р. и др. Эхография нервов, сухожилий и связок // Sonoace International. М., 2005. Вып. 13. С . 82-94.
-
Кованов В.В., Навроцкая В.В., Андреев И.Д. Топографическая анатомия верхней конечности // Оперативная хирургия и топографическая анатомия / Под ред. В.В. Кованова М.: Медицина, 1985. С. 4-35.
-
Еськин И.А., Матвеева Н.Ю., Приписнова С.Г. Возможности ультразвукового исследования в диагностике повреждений и заболеваний периферических нервов верхней конечности // Вестник травматологии и ортопедии им. Н.Н. Приорова. 2008. № 2. С. 82-88.
-
Матвеева Н.Ю., Еськин Н.А. Методы визуализации в диагностике патологии плечевого сплетения // Вестник травматологии и ортопедии им. Н.Н. Приорова. 2010. № 2. С. 82-85.
-
Миронов С.П., Еськин Н.А., Матвеева Н.Ю., Приписнова С.Г., Огарев Е.В. Ультразвуковое исследование плечевого сплетения // Вестник травматологии и ортопедии им. Н.Н. Приорова. 2008. № 4. С. 23-28.
-
Beekman R., Visser L.H. High-resolution sonography of the peripheral nervous system a review of the literature // Eur J Neurol. 2004. Vol. 11. № 5. P. 305-314.
-
Chen S.H., Tsai T.M. Ulnar tunnel syndrome // Hand Surg Am. 2014. Vol. 39. № 3. P. 571-579.
-
Chiou H.J. Chou Y.H., Cheng S.P. et al. Cubital tunnel syndrome: diagnosis by high-resolution ultrasonography // J. Ultrasound Med. 1998. Vol 17. № 10. P. 643-648.
-
Dart Jr. L.H. MacCarty C.S. et al. Neoplasms of the brachial plexus.// Minn Med. 1970. Vol. 53. № 9. Р. 959-964.
-
Haber H.P., Sinis N. et al. Sonography of Brachial Plexus Traction Injuries // Am. J. Roentgenol. 2006. Vol. 186. № 6. Р. 1787-1791.
-
Graif M., Martinoli C., Rochkind S. et al. Sonographic evaluation of brachial plexus pathology // Eur Radiol. 2004. Vol. 14. № 2. Р. 193-200.
-
Martinoli C., Bianchi S., Santacroce E. et al. Brachial plexus sonography: a technique for assessing the root level // Am. J. Roentgenol. 2002. Vol. 179. №9. P. 699-702.
-
McDonagh C., Alexander M. et al. The role of ultrasound in the diagnosis and management of carpal tunnel syndrome: a new paradigm // Rheumatology (Oxford). 2015. Vol. 24. №8. Р. 9-19.
-
Nagaoka M., Matsuzaki H. Ultrasonography in tarsal tunnel syndrome // J. Ultrasound. Med. 2005. Aug. Vol. 24. № 8. Р. 1035-1040.
-
Peer S., Bodner G. High-Resolution Sonography of the Peripheral Nervous System // 2003. Springer. 140 p.
-
Plaikner M., Loizides A. et al. Thickened hyperechoic outer epineurium, a sonographic sign suggesting snapping ulnar nerve syndrome? Ultraschall Med. 2013. Feb. Vol. 34. № 1. Р. 58-63.
-
Roll S.C., Volz K.R. et al. Carpal tunnel syndrome severity staging using sonographic and clinical measures // Muscle Nerve. 2014 Oct 7. doi: 10.1002/mus.24478.
-
Silvestri E., Martinoli C., Derchi L.E. Echotexture of peripheral nerves: correlation between US and histologic findings and criteria to differentiate tendons // Radiology. 1995. Vol. 197. № 2. P. 291-296.
-
Stewart JD Peripheral nerve fascicles: anatomy and clinical relevance // Muscle Nerve. 2003. Vol. 28. № 5. P. 525-541.
-
Stuart R.M., Koh E.S.C., Breidahl W.H. Sonography of Peripheral Nerve Pathology // Am. J. Roentgenol. 2004. Vol. 182. № 1. Р. 123-129.
-
Tsai W.-C., Chiou H.-J., Chou Y.-H. et al. Differentiation Between Schwannomas and Neurofibromas in the Extremities and Superficial Body. The Role of High-Resolution and Color Doppler Ultrasonography // J. Ultrasound. Med. 2008. Vol. 27. № 1. P. 161-166.
-
Wiesler E.R. et al. Ultrasound in the diagnosis of ulnar neuropathy at the cubital tunnel // J. Hand. Surg. Am. 2006. Sep;31(7). Р. 1088-1093.